Usuaria:ElsaBornFree/Trifluorometilación
La trifluorometilación en química orgánica describe cualquier reacción orgánica que introduce un grupo trifluorometilo en un compuesto orgánico. [1] [2] [3] [4] Los compuestos trifluorometilados tienen cierta importancia en la industria farmacéutica y agroquímica . Varios notables compuestos farmacéuticos tienen un grupo trifluorometilo incorporado: fluoxetina, mefloquina, Leflunomida, nulitamida, dutasterida, bicalutamida, aprepitant, celecoxib, fipronil, fluazinam, pentiopirad, picoxistrobina, fluridona, norflurazona, sorafenib y triflurazin . Un agroquímico relevante es la trifluralina . El desarrollo de métodos sintéticos para agregar grupos trifluorometilo a compuestos químicos es objeto frecuente de investigación académica.
Historia[editar]
El primero en investigar los grupos trifluorometilo en relación con la actividad biológica fue F. Lehmann en 1927. [5] Una revisión inicial apareció en 1958. [6] Frédéric Swarts desarrolló un método de síntesis temprano en 1892, [7] basado en el fluoruro de antimonio . En esta reacción, el benzotricloruro se hacía reaccionar con SbF3 para formar PhCF2Cl y PhCF3 . En la década de 1930, Kinetic Chemicals e IG Farben reemplazaron eñ SbF3 con HF.. La reacción McLoughlin-Thrower (1968) es una reacción de acoplamiento temprana que utiliza yodofluoroalcanos, compuestos yodoaromáticos y cobre. [8] En 1969 Kobayashi y Kumadaki adaptaron su protocolo para trifluorometilaciones. [9] [10]

|
| Reacción de McLoughlin-Thrower (1968) |
Reactivos[editar]
Trifluorometiltrimetilsilano[editar]
Ingo Ruppert informó sobre la preparación del trifluorometiltrimetilsilano en 1984. [11] En 1989, Prakash y Olah informaron por primera vez acerca de la activación de TMSCF 3 por el fluoruro para realizar la trifluorometilación nucleofílica de compuestos de carbonilo. [12] En el mismo año, Stahly describió reacciones similares para la síntesis de fenoles y anilinas trifluorometilados. [13] Desde entonces, se ha utilizado ampliamente TMSCF3 como agente trifluorometilante nucleofílico. [14] [15]
Un ejemplo es la trifluorometilación de la ciclohexanona en THF usando fluoruro de tetrabutilamonio . [16]

|
| Trifluorometilación usando
trifluorometiltrimetilsilano [16] |
Los sustratos pueden ser haluros de arilo. [17] [18] El (trifluorometil) trimetoxiborato de potasio para este propósito se ha sintetizado a partir de B(OMe)3, CF3 SiMe3 y KF. [19] También se ha informado de funcionalización de arilos por activación de C-H. [20] [21]
Trifluoroacetato de sodio[editar]
El trifluoroacetato de sodio como reactivo para las trifluorometilaciones fue introducido por Matsui en 1981. Originalmente, el sustrato era un haluro aromático y la sal metálica, yoduro de cobre (I). [22] [23]
Trifluorometano[editar]
El fluoroformo (CF3H) se ha empleado como reactivo de trifluorometilación para aldehídos en combinación con una base fuerte [24]

|
| Trifluorometilación fluoroform folleas 1998 [24] |
Trifluoroyodometano[editar]
El trifluoroyodometano es un reactivo en reacciones de acoplamiento aromático. También se ha utilizado con enonas, por ejemplo con chalcona, una reacción catalizada por Dietilzinc y catalizador de Wilkinson : [25]
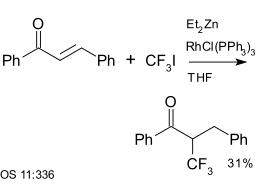
|
| Trifluorometilación con dietil zinc y catalizador de Wilkinson [25] |
Trifluorometil sulfona[editar]
La trifluorometil sulfona (PhSO 2 CF 3 ) y el trifluorometil sulfóxido (PhSOCF 3 ) pueden usarse para trifluorometilaciones de electrófilos [26]
Cloruro de trifluorometanosulfonilo[editar]
El cloruro de trifluorometanosulfonilo (o cloruro de triflilo, CF3SO2Cl) puede usarse en un método altamente eficiente para introducir un grupo trifluorometilo en sistemas aromáticos y heteroaromáticos, incluidos productos farmacéuticos conocidos como Lipitor . Utiliza un catalizador fotordoxo y una fuente de luz a temperatura ambiente. [27]
Trifluorometanosulfinato de sodio[editar]
Langlois introdujo el trifluorometanosulfinato de sodio (CF 3 SO 2 Na) como reactivo de trifluorometilación en 1991. [28] La reacción requiere hidroperóxido de t-butilo y generalmente un metal, y se realiza a través de un mecanismo por radicales. El reactivo se ha aplicado con sustratos heterocíclicos [29]

|
| Reactivo de trifluoración Langlois 2011 [29] |
Reactivos Umemoto[editar]
Los reactivos Umemoto son sales (trifluorometil) dibenzoheterocíclicas. [30] [31]
Reactivos metal-trifluorometilo[editar]
Se han preparado muchos complejos metálicos con CF3 , y algunos son útiles para la trifluorometilación. El reactivo más obvio es el CF3 Li, que puede generarse mediante intercambio de yoduro de litio. Sin embargo, este compuesto es inestable incluso a bajas temperaturas. Se degrada a fluoruro de litio y difluorocarbeno. Los reactivos de trifluorometil cobre (I) son más útiles. Estos se generan in situ por reacción de CF3 I con polvo de cobre en solventes polares. [32] El Hg (CF3) 2, preparado por descarboxilación del trifluoroacetato, ha demostrado ser útil para la trifluorometilación de otros metales. [33]
Tipos de reacción[editar]
Reacciones de acoplamiento aromático[editar]
En las reacciones de acoplamiento entre compuestos aromáticos y complejos metal-trifluorometilo, el metal suele ser cobre, Pd y Ni son menos prominentes. [1] Las reacciones son estequiométricas o catalíticas. En la reacción McLoughlin-Thrower (1962), el yodobenceno reacciona con trifluoroyodometano (CF3I) y polvo de cobre en dimetilformamida a 150ºC °C dando trifluorometilbenceno . El intermediato en este tipo de reacción es un complejo de perfluorometil-metal.
Una reacción catalizada por acetato de paladio descrita en 1982 usaba polvo de zinc con el intermediato principal donde se cree que el CF3ZnI con Pd (0) es el catalizador activo. [34] [35] El primer acoplamiento catalizado por cobre se reportó en 2009 y se basaba en un yodoareno, un trifluorometilsilano, yoduro de cobre y 1,10-fenantrolina . [36] Las variaciones incluyen otro donador de CF3 ,el (trifluorometil)trimetoxiborato de potasio , [37] el uso de ácidos aril borónicos [38] [39] o el uso de una sal de trifluorometil sulfonio [40] o de un complejo de trifluorometilcobre (I) fenantrolina. [41] En 2010 se informó una reacción catalizada por paladio utilizando haluros de arilo, (trifluorometil) trietilsilano y dímero de cloruro de alilpalladio [42]

|

|
| Trifluorometilación aromática Kitazume 1982 [34] | Catalítico aromático
trifluorometilación Oishi 2009 [36] |
[[Categoría:Reacciones orgánicas]] [[Categoría:Wikipedia:Páginas con traducciones sin revisar]]
- ↑ a b Tomashenko, O. A.; Grushin, V. V. (2011). «Aromatic Trifluoromethylation with Metal Complexes». Chemical Reviews 111 (8): 4475-4521. PMID 21456523. doi:10.1021/cr1004293.
- ↑ Furuya, T.; Kamlet, A. S.; Ritter, T. (2011). «Catalysis for fluorination and trifluoromethylation». Nature 473 (7348): 470-477. Bibcode:2011Natur.473..470F. PMC 3119199. PMID 21614074. doi:10.1038/nature10108.
- ↑ Besset, T.; Schneider, C. D.; Cahard, D. (2012). «Tamed Arene and Heteroarene Trifluoromethylation». Angewandte Chemie International Edition 51 (21): 5048-5050. PMID 22488902. doi:10.1002/anie.201201012.
- ↑ Alonso, C. N.; Martínez De Marigorta, E.; Rubiales, G.; Palacios, F. (2015). «Carbon Trifluoromethylation Reactions of Hydrocarbon Derivatives and Heteroarenes». Chemical Reviews 115 (4): 1847-1935. PMID 25635524. doi:10.1021/cr500368h.
- ↑ Lehmann, F. "Chemical constitution and activity. Aromatic fluorine compounds." Arch. exp. Pathol. Pharmakol 130 (1928): 250-255.
- ↑ Yale, H. L. (1959). «The Trifluoromethyl Group in Medical Chemistry». Journal of Medicinal and Pharmaceutical Chemistry 1 (2): 121-133. PMID 13665284. doi:10.1021/jm50003a001.
- ↑ Swarts (1892). Acad. Roy. Belg 3 (24): 474.
- ↑ McLoughlin, V. C. R.; Thrower, J. (1969). «A route to fluoroalkyl-substituted aromatic compounds involving fluoroalkylcopper intermediates». Tetrahedron 25 (24): 5921-5940. doi:10.1016/S0040-4020(01)83100-8.
- ↑ Kobayashi, Y.; Kumadaki, I. (1969). «Trifluoromethylation of aromatic compounds». Tetrahedron Letters 10 (47): 4095-4096. doi:10.1016/S0040-4039(01)88624-X.
- ↑ Folléas, B. ̂T.; Marek, I.; Normant, J. F.; Saint-Jalmes, L. (2000). «Fluoroform: An Efficient Precursor for the Trifluoromethylation of Aldehydes». Tetrahedron 56 (2): 275-283. doi:10.1016/S0040-4020(99)00951-5.
- ↑ Ruppert, Ingo; Schlich, Klaus; Volbach, Wolfgang (January 1984). «Die ersten CF3-substituierten organyl(chlor)silane». Tetrahedron Letters 25 (21): 2195-2198. doi:10.1016/S0040-4039(01)80208-2.
- ↑ Prakash, G. K. Surya; Krishnamurti, Ramesh; Olah, George A. (January 1989). «Synthetic methods and reactions. 141. Fluoride-induced trifluoromethylation of carbonyl compounds with trifluoromethyltrimethylsilane (TMS-CF3). A trifluoromethide equivalent». Journal of the American Chemical Society 111 (1): 393-395. doi:10.1021/ja00183a073.
- ↑ Stahly, G. Patrick; Bell, Donald R. (June 1989). «A new method for synthesis of trifluoromethyl-substituted phenols and anilines». The Journal of Organic Chemistry 54 (12): 2873-2877. doi:10.1021/jo00273a020.
- ↑ G. K. Surya Prakash; Andrei K. Yudin (1997). «Perfluoroalkylation with Organosilicon Reagents». Chemical Reviews 97 (3): 757-786. PMID 11848888. doi:10.1021/cr9408991.
- ↑ Xiao Liu, Cong Xu, Mang Wang, and Qun Liu (2015). «Trifluoromethyltrimethylsilane: Nucleophilic Trifluoromethylation and Beyond». Chemical Reviews 115 (2): 683-730. PMID 24754488. doi:10.1021/cr400473a.
- ↑ a b Ramaiah, Pichika; Krishnamurti, Ramesh; K. Surya Prakash, G. (1995). «1-TRIFLUOROMETHYL-1-CYCLOHEXANOL». Organic Syntheses 72 (72): 232. doi:10.15227/orgsyn.072.0232.
- ↑ Morimoto, H.; Tsubogo, T.; Litvinas, N. D.; Hartwig, J. F. (2011). «A Broadly Applicable Copper Reagent for Trifluoromethylations and Perfluoroalkylations of Aryl Iodides and Bromides». Angewandte Chemie 123 (16): 3877-3882. doi:10.1002/ange.201100633.
- ↑ Oishi, Masahiro; Kondo, Hideaki; Amii, Hideki (2009). «Aromatic trifluoromethylation catalytic in copper». Chemical Communications 2009 (14): 1909-1911. PMID 19319442. doi:10.1039/B823249K.
- ↑ Knauber, T.; Arikan, F.; Röschenthaler, G.-V.; Gooßen, L. J. (2011). «Copper-Catalyzed Trifluoromethylation of Aryl Iodides with Potassium (Trifluoromethyl)trimethoxyborate». Chemistry: A European Journal 17 (9): 2689-2697. PMID 21274956. doi:10.1002/chem.201002749.
- ↑ Ye, Yingda; Lee, Shin Hee; Sanford, Melanie S. (2011). «Silver-Mediated Trifluoromethylation of Arenes Using TMSCF3». Sanford Organic Letters 13 (20): 5464-5467. PMC 3229100. PMID 21932827. doi:10.1021/ol202174a.
- ↑ Hafner, A.; Bräse, S. (2012). «Ortho-Trifluoromethylation of Functionalized Aromatic Triazenes». Angewandte Chemie International Edition 51 (15): 3713-3715. PMID 22318969. doi:10.1002/anie.201107414.
- ↑ Matsui, Kiyohide; Tobita, Etsuko; Ando, Midori; Kondo, Kiyosi (1981). «A convenient trifluoromethylation of aromatic halides with sodium trifluoroacetate.». Chemistry Letters 10 (12): 1719-1720. doi:10.1246/cl.1981.1719.
- ↑ Langlois, Bernard R.; Roques, Nicolas (October 2007). «Nucleophilic trifluoromethylation of aryl halides with methyl trifluoroacetate». Journal of Fluorine Chemistry 128 (10): 1318-1325. doi:10.1016/j.jfluchem.2007.08.001.
- ↑ a b Folléas, Benoît; Marek, Ilan; Normant, Jean-F; Jalmes, Laurent Saint (May 1998). «Fluoroform: an efficient precursor for the trifluoromethylation of aldehydes». Tetrahedron Letters 39 (19): 2973-2976. doi:10.1016/S0040-4039(98)00391-8.
- ↑ a b Sato, Kazuyuki; Omote, Masaaki; Ando, Akira; Kumadaki, Itsumaro (2006). «TRIFLUOROMETHYLATION AT THE a-POSITION OF b,b-UNSATURATED KETONES: 4-PHENYL-3-(TRIFLUOROMETHYL)BUTAN-2-ONE». Organic Syntheses 83 (83): 177. doi:10.15227/orgsyn.083.0177.
- ↑ Prakash, G. K. Surya; Hu, Jinbo; Olah, George A. (September 2003). «Alkoxide- and Hydroxide-Induced Nucleophilic Trifluoromethylation Using Trifluoromethyl Sulfone or Sulfoxide». Organic Letters 5 (18): 3253-3256. PMID 12943400. doi:10.1021/ol035045u.
- ↑ Nagib, David A.; MacMillan, David W. C. (8 December 2011). «Trifluoromethylation of arenes and heteroarenes by means of photoredox catalysis». Nature 480 (7376): 224-228. Bibcode:2011Natur.480..224N. PMC 3310175. PMID 22158245. doi:10.1038/nature10647.
- ↑ Langlois, Bernard R.; Laurent, Eliane; Roidot, Nathalie (December 1991). «Trifluoromethylation of aromatic compounds with sodium trifluoromethanesulfinate under oxidative conditions.». Tetrahedron Letters 32 (51): 7525-7528. doi:10.1016/0040-4039(91)80524-A.
- ↑ a b Ji, Y.; Brueckl, T.; Baxter, R. D.; Fujiwara, Y.; Seiple, I. B.; Su, S.; Blackmond, D. G.; Baran, P. S. (15 August 2011). «Innate C-H trifluoromethylation of heterocycles». Proceedings of the National Academy of Sciences 108 (35): 14411-14415. Bibcode:2011PNAS..10814411J. PMC 3167544. PMID 21844378. doi:10.1073/pnas.1109059108.
- ↑ Zhang, Cai (11 July 2014). «Recent advances in trifluoromethylation of organic compounds using Umemoto's reagents». Organic & Biomolecular Chemistry 12 (34): 6580-9. PMID 25011917. doi:10.1039/C4OB00671B.
- ↑ Li, Huiqin (3 September 2012). «Umemoto's Reagent». Synlett 23 (15): 2289-2290. doi:10.1055/s-0032-1317176.
- ↑ Donald J. Burton, Long Lu "Fluorinated Organometallic Compounds" Topics in Current Chemistry, 1997, Vol. 193, p. 45.
- ↑ Reint Eujen "Bis(Trifluoromethyl)Mercury" 1986, volume 24, p. 52. doi 10.1002/9780470132555.ch16
- ↑ a b Kitazume, Tomoya; Ishikawa, Nobuo (1982). «Palladium-Catalyzed Cross-Coupling Reactions Between Allyl, Vinyl or Aryl Halide and Perfluoroalkyl Iodide with Zinc and Ultrasonic Irradiation». Chemistry Letters 11 (1): 137-140. doi:10.1246/cl.1982.137.
- ↑ Kitazume, Tomoya; Ishikawa, Nobuo (1985). «Ultrasound-promoted selective perfluoroalkylation on the desired position of organic molecules». Journal of the American Chemical Society 107 (18): 5186-5191. doi:10.1021/ja00304a026.
- ↑ a b Oishi, M.; Kondo, H.; Amii, H. (2009). «Aromatic trifluoromethylation catalytic in copper». Chem. Commun. 2009 (14): 1909-1911. PMID 19319442. doi:10.1039/B823249K.
- ↑ Knauber, T.; Arikan, F.; Roschenthaler, G.-V.; Gooßen, L. J. (2011). «Copper-catalyzed trifluoromethylation of aryl iodides with potassium (trifluoromethyl) trimethoxyborate». Chem. Eur. J. 17 (9): 2689-2697. PMID 21274956. doi:10.1002/chem.201002749.
- ↑ Chu, L.; Qing, F.-L. (2010). «Copper-mediated oxidative trifluoromethylation of boronic acids». Org. Lett. 12 (21): 5060-5063. PMID 20923196. doi:10.1021/ol1023135.
- ↑ Senecal, Todd D.; Parsons, Andrew T.; Buchwald, Stephen L. (18 February 2011). «Room Temperature Aryl Trifluoromethylation via Copper-Mediated Oxidative Cross-Coupling». The Journal of Organic Chemistry 76 (4): 1174-1176. PMC 3093444. PMID 21235259. doi:10.1021/jo1023377.
- ↑ Cheng-, Cheng-Pan; Zhang, Pan; Wang, Ling et al. (2011). «Copper-mediated trifluoromethylation of heteroaromatic compounds by trifluoromethyl sulfonium salts». Angew. Chem. Int. Ed. 50 (8): 1896-1900. PMID 21328665. doi:10.1002/anie.201006823.
- ↑ Morimoto, H.; Tsubogo, T.; Litvinas, N. D.; Hartwig, J. F. (2011). «A broadly applicable copper reagent for trifluoromethylations and perfluoroalkylations of aryl iodides and bromides». Angew. Chem. Int. Ed. 50 (16): 3793-3798. PMC 3159489. PMID 21442711. doi:10.1002/anie.201100633.
- ↑ Cho, E. J.; Senecal, T. D.; Kinzel, T.; Zhang, Y.; Watson, D. A.; Buchwald, S. L. (24 June 2010). «The Palladium-Catalyzed Trifluoromethylation of Aryl Chlorides». Science 328 (5986): 1679-1681. Bibcode:2010Sci...328.1679C. PMC 3005208. PMID 20576888. doi:10.1126/science.1190524.

