Transporte mediado
| Transporte de membrana | ||
|---|---|---|
| Mecanismos de transporte químico a través de membranas biológicas | ||
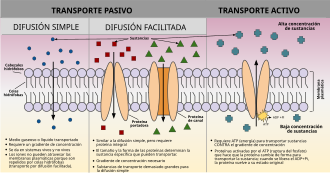 | ||
| Transporte pasivo |
| |
| Transporte activo | ||
| Citosis | ||
| Endocitosis | ||
| Exocitosis |
| |
| Otras formas de transporte anexas son: el Transporte paracelular y el Transporte transcelular. Su movimiento opuesto se conoce como Transporte inverso. | ||
El transporte mediado se refiere al transporte mediado por una proteína de transporte de membrana. Las sustancias en el cuerpo humano pueden ser hidrofóbicas, electrofílicas, contener una carga positiva o negativa, o tener otra propiedad. Como tal, hay momentos en que esas sustancias no pueden atravesar la membrana celular utilizando un movimiento independiente de proteínas.[1] La membrana celular está incrustada con muchas proteínas de transporte de membrana que permiten que dichas moléculas entren y salgan de la célula.[2] Una molécula se unirá a una proteína transportadora, alterando su forma. El cambio de forma u otras sustancias añadidas como ATP, a su vez, harán que la proteína de transporte altere su forma y libere la molécula al otro lado de la membrana celular.[3]
Tipos de transportadores mediados[editar]
Hay tres tipos de transportadores mediados: uniportador, simportador y antiportador. Las cosas que se pueden transportar son nutrientes, iones, glucosa, etc., todo dependiendo de las necesidades de la célula.
- Uniportador: Permite el transporte de un soluto a la vez
- Simportador: Transporta soluto y contratransporta otro soluto al mismo tiempo y en la misma dirección
- Antiportador: Transporta el soluto en una dirección mientras que el soluto contratransportado se mueve en la dirección opuesta dentro o fuera de la célula[4]

Tipos de Transporte[editar]
Existen dos tipos de transporte considerados como mediados:[5]
- Difusión facilitada: es el proceso de transporte pasivo espontáneo de moléculas o iones a través de una membrana biológica a través de proteínas integrales transmembrana específicas. No requiere directamente energía química de la hidrólisis de ATP en el paso de transporte en sí; más bien, las moléculas y los iones se mueven a favor de su gradiente de concentración, lo que refleja su naturaleza difusiva.[6]
- Transporte activo: El término hace referencia al movimiento de las moléculas a través de una membrana celular desde una región de baja concentración a una región de alta concentración, o en dirección opuesta a algún gradiente o a algún otro factor obstructivo (con frecuencia en la dirección opuesta al gradiente de concentración).
| Difusión facilitada | Transporte activo |
|---|---|
| No se necesita fuente de energía | Requiere ATP |
| Mueve la sustancia de alta a baja concentración | Puede crear gradientes de concentración y mueve moléculas de bajas a altas concentraciones[7] |
| Proteína de transporte requerida | Proteína de transporte requerida |
Proteínas de Transporte[editar]
Una proteína de transporte es una proteína que cumple la función de mover otros materiales dentro de un organismo. Las proteínas de transporte son vitales para el crecimiento y la vida de todos los seres vivos. Hay varios tipos diferentes de proteínas de transporte.
Tipos de proteínas[editar]
Mediadas por uniportador[editar]
Un ejemplo de una proteína de transporte mediada por uniportador es la GLUT1. La GLUT1 es una proteína transmembrana, lo que significa que abarca todo el ancho de la membrana celular, conectando la región extracelular e intracelular. Es un sistema uniporte porque transporta glucosa específicamente en una sola dirección, a favor de su gradiente de concentración a través de la membrana celular.
Otro ejemplo de una proteína de transporte mediada por uniportador es la proteína de transferencia de triglicéridos microsómicos (MTTP) que es responsable de catalizar el ensamblaje de las lipoproteínas ricas en triglicéridos y de mediar en su liberación desde la luz del retículo endoplásmico. Lo que se distingue de esta proteína de transferencia específica es que requiere que la proteína PRAP1 se una a la lipoproteína para facilitar el transporte de dicha lipoproteína. MTTP solo reconoce el complejo PRAP1-lipoproteína y solo entonces catalizará la reacción de transporte.[8] En cierto modo, la proteína PRAP1 actúa como una señal para MTTP. La importancia de tales interacciones implica que el transporte mediado no únicamente depende de las proteínas transmembrana, sino que también puede requerir la presencia de proteínas adicionales no transmembrana. Por ejemplo, los estudios muestran que, en ausencia de una proteína PRAP1 completamente funcional, el MTTP no puede transportar lipoproteínas específicas a través de la membrana del retículo endoplásmico.
Mediadas por uniportador
Un ejemplo de proteína de transporte mediada por simportador es SGLT1, una proteína cotransportadora de sodio/glucosa que se encuentra principalmente en el tracto intestinal. La proteína SGLT1 es un sistema simportador porque pasa glucosa y sodio en la misma dirección, desde la luz del intestino hacia el interior de las células intestinales.[9]
Mediadas por antiportador
Un ejemplo de una proteína de transporte mediada por antiportador es el antiportador de sodio-calcio, una proteína de transporte involucrada en mantener baja la concentración citoplasmática de iones de calcio en las células. Esta proteína de transporte es un sistema antiportador porque transporta tres iones de sodio a través de la membrana plasmática a cambio de un ion de calcio, que se transporta en dirección opuesta.[10]
Mutaciones[editar]
La importancia de las proteínas de transporte mediadas se visualiza con la presencia de mutaciones que hacen que las proteínas de transporte no funcionen. Un buen ejemplo de esto son las mutaciones que se encuentran en el gen Archain 1 que codifica las proteínas de transporte COPI y COPII. La función principal de estas proteínas de transporte es facilitar el paso de moléculas desde el retículo endoplasmático al aparato de Golgi, y viceversa. El gen ARCN1 mutado da lugar a COPI anormal que no puede transportar colágeno tipo I y conduce a la secreción de colágeno.[11] Debido al hecho de que el colágeno tipo I es el ingrediente principal del tejido conectivo, tales mutaciones son la causa de numerosos trastornos esqueléticos graves, como la osteogénesis imperfecta y la displasia cráneo-lenticulo-sutural. Varias variaciones de estos trastornos se caracterizan por una displasia física visible.
Referencias[editar]
- ↑ Lodish, Berk, Zipursky, H,A,SL (2000). Molecular Cell Biology. 4th edition. New York: W.H. Freeman. pp. Ch. 15.
- ↑ "Protein-Mediated Transport". content.openclass.com. Retrieved 2018-10-23.
- ↑ Grassl, Steven M. (1 de enero de 2001). «Mechanisms of Carrier-Mediated Transport: Facilitated Diffusion, Cotransport, and Countertransport». Cell Physiology Source Book: 249-259. ISBN 9780126569766. doi:10.1016/B978-012656976-6/50108-6.
- ↑ WOLFERSBERGER, MICHAEL (1994). «Uniporters, symporters and antiporters». Department of Biology, Temple University, Philadelphia, PA 19122, USA 196: 5-6. PMID 7823043. Archivado desde el original el 29 de noviembre de 2018.
- ↑ Byers; Sarver, James P.; Jeffery G. (2009). Pharmacology Principles and Practice. Academic Press. pp. 201-277.
- ↑ Voet, Judith G.; Pratt, Charlotte W. (2002). Fundamentals of biochemistry upgrade (en inglés) ([Rev. ed.] edición). Wiley. pp. 264-266. ISBN 0-471-41759-9. OCLC 46538398.
- ↑ Hille, Bertil (2001). Ion Channels of Excitable Membranes. 23 Plumtree Road, Sunderland, MA, 01375: Sinauer Associates, Inc. pp. 359.
- ↑ Peng, Hubert et al. (2021). «PRAP1 Is a Novel Lipid-Binding Protein That Promotes Lipid Absorption by Facilitating MTTP-Mediated Lipid Transport». The Journal of Biological Chemistry 296: 100052. PMC 7949078. PMID 33168624. doi:10.1074/jbc.RA120.015002.
- ↑ Reference, Genetics Home. «SLC5A1 gene». Genetics Home Reference. Consultado el 14 de mayo de 2019.
- ↑ Reeves, J. P.; Condrescu, M.; Chernaya, G.; Gardner, J. P. (November 1994). «Na+/Ca2+ antiport in the mammalian heart». The Journal of Experimental Biology 196: 375-388. ISSN 0022-0949. PMID 7823035. doi:10.1242/jeb.196.1.375.
- ↑ Izumi, Kosuke et al. (4 de agosto de 2016). «ARCN1 Mutations Cause a Recognizable Craniofacial Syndrome Due to COPI-Mediated Transport Defects». American Journal of Human Genetics 99 (2): 451-459. PMC 4974084. PMID 27476655. doi:10.1016/j.ajhg.2016.06.011.
Enlaces externos[editar]
- Voet, Donald; Voet, Judith G.; Pratt, Charlotte W. Fundamentos de bioquímica: vida a nivel molecular Archivado el 18 de julio de 2015 en Wayback Machine. . Capítulo 10. "Transporte de membrana" pags. 286-310
