Tejido linfoide asociado con el intestino
El tejido linfoide asociado con el intestino[1] (GALT, por sus siglas en inglés Gut-associated lymphoid tissue)[2] es un componente del tejido linfoide asociado a mucosas (MALT) o sistema inmunitario de mucosas que protege el individuo de invasiones en el intestino.
Debido a su función fisiológica en la absorción de nutrientes, la superficie mucosa del intestino es delgada y actúa como una barrera permeable al interior del cuerpo. De mismo modo, dicha permeabilidad crea mayor vulnerabilidad a infecciones y, de hecho, la gran mayoría de agentes infecciosos que invaden el cuerpo humano usan la mucosa intestinal como vía de entrada.[3] Por ese motivo GALT alberga la mayor población de células plasmáticas, productoras de anticuerpos, cuyo número total excede el número de células plasmáticas en bazo, nódulos linfáticos y médula ósea juntos.[4]
Estructura
El tejido linfoide asociado con el intestino se extiende a lo largo del intestino, cubriendo un área de aproximadamente 260-300 m2.[5] Con tal de incrementar la superficie de absorción, la mucosa emite unas prolongaciones digitiformes llamadas vellosidades o villi. Está cubierta de una monocapa de células epiteliales, llamadas enterocitos, que separan el GALT del lumen intestinal y su contenido, el cual está recubierto por una capa de glicocálix en su superficie luminal para proteger las células del pH ácido del lumen.
Constantemente se producen nuevas células epiteliales derivadas de células madre en el fondo de las glándulas intestinales, con el objetivo de regenerar el epitelio (se renueva completamente en menos de una semana).[3][6] Aunque el tipo dominante de células sean los enterocitos convencionales, también se pueden encontrar células de Paneth en el fondo de las criptas que forman el epitelio. Estas secretan sustancias antibacterianas, entre ellas lisozima, y se cree que están involucradas en el control de infecciones. Por debajo de ellas, se encuentra una capa subyacente de tejido conectivo llamado lámina propia. Además, hay circulación linfática por todo el tejido conectada a los nódulos linfáticos mesentéricos.
Tanto en GALT como en los nódulos linfáticos mesentéricos se empieza la respuesta inmune debido a la presencia de células inmunes en el epitelio y en la lámina propia. En GALT se encuentran además placas de Peyer que no son más que folículos linfoides aislados distribuidos a lo largo del intestino y del apéndice en humanos.[3]
Placas de Peyer
Las placas de Peyer son agregados de células linfoides proyectados hacia el lumen del intestino que actúan como un punto muy importante para la iniciación de la respuesta inmune. Desarrolla un dominio subepitelial con gran número de folículos de células B, áreas de células T entre ellos y células dendríticas. En esta área, el dominio subepitelial se separa por un una capa de epitelio asociado al folículo del lumen intestinal. Este epitelio contiene células epiteliales intestinales convencionales y algunas células epiteliales especializadas llamadas células M ó células Microfold-en Inglés-microfold cell entre ellas. A diferencia de los enterocitos, las células M no presentan microvilli en su superficie luminal, no secretan enzimas digestivas ni moco y no están recubiertas de glicocálix. Muchos microorganismos se ven atraídos por dicha libre superficie e invaden el cuerpo a través de las células M.[3]
Función
El trato digestivo es un componente importante del sistema inmunitario. De hecho, el intestino tiene la mayor cantidad de tejido linfoide del cuerpo.[7]
Investigaciones recientes indican que GALT podría ser el mayor sitio de actividad del virus de inmunodeficiencia humana (VIH), aún y cuando los tratamientos han logrado reducir el recuento de virus en el sistema circulatorio periférico.[8][9]
Internalización del antígeno
Las células M en el epitelio asociado a los folículos de las placas de Peyer y de los folículos linfoides aislados están internalizando antígenos presentes en el intestino constantemente. Estos antígenos son endocitados o fagocitados, transportados en vesículas por el citoplasma de las células M y liberados posteriormente en la superficie basal, un proceso conocido como transcitosis. Estos antígenos serán capturados por células dendríticas, las cuales los presentarán a las células T.[3]
Otros animales
La inmunidad adaptativa, mediada por anticuerpos y células T, es propia de vertebrados. Mientras todos ellos presentan tejido linfático asociado al intestino y la mayoría tienen alguna versión de bazo y timo, no todos los vertebrados muestran médula ósea, nódulos linfáticos o centros germinales, lo cual significa que no todos los vertebrados pueden generar linfocitos en la médula ósea.[4] Esta distribución distinta de los órganos adaptativos en los diferentes grupos de vertebrados sugiere que GALT podría ser la primera forma de sistema inmune adaptativo en vertebrados. Además se ha sugerido que a partir de este GALT ya existente y debido a la presión puesta por parte de las bacterias comensales en el intestino que coevolucionaron con los vertebrados, especializaciones más tardías como el timo, el bazo o los nódulos linfáticos aparecerían como parte del sistema inmune adaptativo.[3]
Imágenes adicionales
-
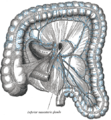
Sistema linfático en el colon.
-
Sección de esófago humano.
-
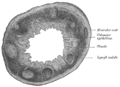
Sección transversal de apéndice vermiforme humano (X 20).
-
Sección de la mucosa en el recto humano (X 60).
Referencias
- ↑ Charles., Janeway,; P., Murphy, Kenneth; 1956-, Travers, Paul,; Mark., Walport, (1 de enero de 2009). Inmunobiología de Janeway. McGraw-Hill. ISBN 9789701073476. OCLC 537076841.
- ↑ Janeway, CA Jr. (2001). «The mucosal immune system». Immunobiology. New York: Garland Science. 10-13. ISBN 0-8153-3642-X.
- ↑ a b c d e f Murphy, K. (2011). Janeway's immunobiology (Immunobiology: The Immune System (Janeway)). Garland Science. ISBN 9780815342434. OCLC 733935898.
- ↑ a b Goldsby, R. A.; Osborne, B. A.; Kindt, T. J.; Kuby, J. (1 de enero de 2007). Kuby immunology. W.H. Freeman. ISBN 9780716767640. OCLC 68207318.
- ↑ Helander, Herbert F.; Fändriks, Lars (1 de junio de 2014). «Surface area of the digestive tract – revisited». Scandinavian Journal of Gastroenterology 49 (6): 681-689. ISSN 0036-5521. doi:10.3109/00365521.2014.898326.
- ↑ Slomianka, Lutz. «Blue Histology - Gastrointestinal Tract». www.lab.anhb.uwa.edu.au. Consultado el 30 de enero de 2017.
- ↑ Salminen S, Bouley C, Boutron-Ruault MC, etal (1998). «Functional food science and gastrointestinal physiology and function». British Journal of Nutrition 80 (S1): S147-S171. doi:10.1079/BJN19980108.
|coautores=requiere|autor=(ayuda) - ↑ Moraima Guadalupe,1 Sumathi Sankaran,1 Michael D. George,1 Elizabeth Reay,1 David Verhoeven,1 Barbara L. Shacklett,1 Jason Flamm,4 Jacob Wegelin,3 Thomas Prindiville,2 and Satya Dandekar. Viral Suppression and Immune Restoration in the Gastrointestinal Mucosa of HIV Type 1-Infected Patients Initiating Therapy during Primary or Chronic Infection Journal of Virology, August 2006, p. 8236-8247, Vol. 80, No. 16
- ↑ Anton PA, Mitsuyasu RT, Deeks SG, Scadden DT, Wagner B, Huang C, Macken C, Richman DD, Christopherson C, Borellini F, Lazar R, Hege KM. Multiple measures of HIV burden in blood and tissue are correlated with each other but not with clinical parameters in aviremic subjects. AIDS. 2003 Jan 3;17(1):53-63.
Enlaces externos
- Plantilla:BUHistology - "Digestive System: Alimentary Canal: colon, taenia coli"
- Plantilla:BUHistology - "Digestive System: Alimentary Canal: esophageal/stomach junction"