Síntesis de indoles de Gassman
La Síntesis de indoles de Gassman es un método de síntesis orgánica que consiste en la preparación de indoles sustituidos a partir de anilinas secundarias y metilsulfurocetonas en presencia de hipohalogenitos orgánicos.

Se trata de una reacción química en donde no se realizan procedimientos de separación, es decir, todas las reacciones se llevan a cabo sobre la misma mezcla. El grupo R1 puede ser hidrógeno o alquilo, mientras que R2 funciona mejor con un sustituyente arilo, pero también puede ser alquilo. Las reacciones no proceden con anilinas ricas en electrones, tales como la 4-metoxianilina.
El grupo metilsulfuro de la posición 3 del indol formado a menudo se extrae utilizando níquel Raney para obtener el 3-H-indol.
Mecanismo de reacción
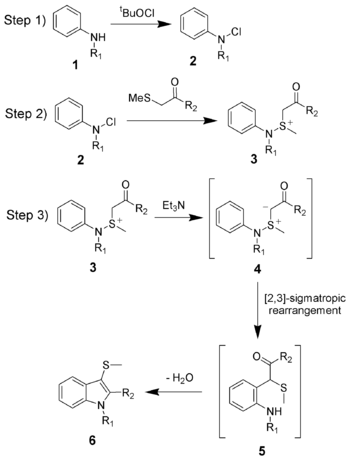
La síntesis de indoles de Gassman se divide en cuatro reacciones.
- 1) Oxidación de la anilina 1 utilizando hipoclorito de ter-butilo (tBuOCl) para obtener la cloramina 2.
- 2) Adición de la cetona para dar el ion sulfonio 3, y se realiza normalmente a bajas temperaturas (-78 º C).
- 3) Adición de una base, que en este caso es trietilamina. Tras el calentamiento a la temperatura ambiente, la base desprotona el ion sulfonio para dar el iluro de sulfonio 4, que rápidamente se somete a una transposiciíon sigmatrópica [2,3] para dar la cetona 5.
- 4) Formación de la base de Schiff entre la cetona y la anilina, con su posterior tautomerización a enamina, la cual es favorecida por la ganancia de energía de resonancia del indol.
Véase también
- Síntesis de indoles de Bartoli
- Síntesis de indoles de Bischler-Möhlau
- Síntesis de indoles de Fischer
- Síntesis de indoles de Fukuyama
- Síntesis de indoles de Hemetsberger
- Síntesis de indoles de Hinsberg
- Síntesis de indoles de Larock
- Síntesis de indoles de Leimgruber-Batcho
- Síntesis de indoles de Nenitzescu
- Síntesis de indoles de Reissert
- Síntesis de indoles de Madelung
Referencias
- Gassman, P. G.; Gruetzmacher, G.; van Bergen, T. J. J. Am. Chem. Soc., 1973, 95, 6508.
- Gassman, P. G.; van Bergen, T. J.; Gilbert, D. P.; Cue, Jr., B. W. J. Am. Chem. Soc., 1974, 96, 5495.
- Gassman, P. G.; van Bergen, T. J. J. Am. Chem. Soc., 1974, 96, 5508.
- Gassman, P. G.; Gruetzmacher, G.; van Bergen, T. J. J. Am. Chem. Soc., 1974, 96, 5512.
- Organic Syntheses, Coll. Vol. 6, p.601; Vol. 56, p.72 (Article)