Reacción de Ugi

La reacción de Ugi es una reacción multicomponente en química orgánica que involucra una cetona o aldehído, una amina, un isocianuro y un ácido carboxílico para formar una diamina[1][2][3][4]. La reacción toma su nombre del químico alemán Ivar Karl Ugi, quien la reportó por primera vez en 1959. La reacción de Ugi es exotérmica y usualmente se lleva a cabo en pocos minutos después de añadir el isocianuro. Altas concentraciones (0.5 - 2.0 mol L-1) de reactivos dan los mejores resultados. Solventes apróticos polares como la DMF favorecen la reacción sin embargo también se ha llevado a cabo satisfactoriamente en metanol y etanol. Esta reacción no catalizada tiene una alta economía atómica pues solamente se pierde una molécula de agua y el rendimiento general es alto.[5][6][7][8][9][10][11]
Debido a que los productos de reacción son componentes potenciales de proteínas sintéticas, se han realizado intentos para desarrollar una reacción de Ugi enantioselectiva[12] siendo reportada la primera reacción exitosa en 2018.[13]
Mecanismo de reacción
Un mecanismo de reacción plausible se muestra a continuación:[14]

La amina (1) y la cetona (2) forman la imina (3) mediante dos ataques nucleofílicos sucesivos de la amina al carbono carbonílico de la cetona. En este proceso se pierde un equivalente de agua. El ácido carboxílico (4) protona a la imina (3) para activarla al formar el ion iminio (5), el cual sufre un ataque nucleofílico por el carbanión del isocianuro (6) para formar el ion (7). Una segunda adición nucleofílica sucede en este intermediario mediante el ataque del carboxilato al carbono de ion nitrilio para formar el producto (8). El paso final es un rearreglo que transfiere el grupo acilo que contiene a R4 del oxígeno al nitrógeno. Todos los pasos de reacción son reversibles excepto este último, lo que desplaza toda la secuencia de reacción hacia la formación de productos.
En la reacción de Passerini (similar pero sin la amina), el isocianuro reacciona directamente con el grupo carbonilo sin alterar el resto de la secuencia por lo que esta reacción es una fuente de impurezas al llevar a cabo la reacción de Ugi.
Variaciones
Combinación de los componentes de reacción.
El uso de reactivos bifuncionales incrementa la posibilidad de formar diversos subproductos. De esta forma, diversas combinaciones conducen a productos estructuralmente interesantes. La reacción de Ugi ha sido aplicada en combinación con una reacción intramolecular de Diels-Alder.[15]
Una reacción por cuenta propia es la reacción de Ugi-Smiles, que reemplaza el ácido carboxílico por un fenol. En esta reacción, el rearreglo final es reemplazado por el rearreglo de Smiles.[16]
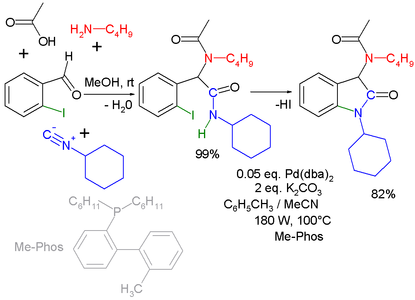
Otra combinación (que requiere la purificación del intermediario de Ugi) es la que se lleva a cabo con la reacción de Buchwald-Hartwig[17] Así como la reacción de Ugi-Heck para acoplamiento de arilos.[18]
Combinación de aminas y ácidos carboxílicos
Algunos investigadores han usado β-aminoácidos en la reacción de Ugi para preparar β-lactamas[19]. Esta modificación está basada en la transferencia del acilo en el rearreglo final para formar un anillo de cuatro miembros. La reacción procede con un rendimiento moderado a temperatura ambiente en una mezcla de disolventes metanol-formaldehído o en una variedad de aril-aldehídos.
Combinación de compuestos carbonílicos y ácidos carboxílicos
Zhang et al.[20] han usado la reacción de Ugi y combinado aldehídos con ácidos carboxílicos para formar lactamas de diferentes tamaños. Short et al.[21] han sintetizado γ-lactamas a partir de cetoácidos sobre soporte sólido.
- Variaciones de la reacción de Ugi
-
Reacción de Ugi combinada con Diels-Alder
-
Reacción de Ugi-Smiles
-
Reacción de Ugi-Buchwald-Hartwig
-
Reacción de Ugi-Heck

Aplicaciones
Bibliotecas químicas
La reacción de Ugi fue una de las primeras reacciones en ser usadas para el desarrollo de bibliotecas químicas. Estas bibliotecas son conjuntos de compuestos que pueden ser analizados repetidamente. Usando los principios de la química combinacional, la reacción de Ugi ofrece la posibilidad de sintetizar un gran número de compuestos mediante una reacción usando una variedad de cetonas (o aldehídos), aminas, isocianuros y ácidos carboxílicos. Estas librerías pueden ser probadas con enzimas u organismos vivientes para encontrar nuevas sustancias con actividad farmacológica. Una desventaja es la falta de diversidad química de los productos, aunque usando la reacción de Ugi en combinación con otras reacciones, se puede hacer crecer la diversidad de los productos posibles.
Industria farmacéutica
El crixivan puede ser sintetizado mediante la reacción de Ugi.[22]
Referencias
- ↑ «Versammlungsberichte». Angewandte Chemie (en inglés) 71 (11): 373-388. 1959. ISSN 1521-3757. doi:10.1002/ange.19590711110. Consultado el 29 de abril de 2020.
- ↑ Ugi, I.; Steinbrückner, C. (1960). «Über ein neues Kondensations-Prinzip». Angewandte Chemie (en inglés) 72 (7-8): 267-268. ISSN 1521-3757. doi:10.1002/ange.19600720709. Consultado el 29 de abril de 2020.
- ↑ Ugi, Ivar (1962). «The α-Addition of Immonium Ions and Anions to Isonitriles Accompanied by Secondary Reactions». Angewandte Chemie International Edition in English (en inglés) 1 (1): 8-21. ISSN 1521-3773. doi:10.1002/anie.196200081. Consultado el 29 de abril de 2020.
- ↑ Boltjes, André (2017). «Ugi Multicomponent Reaction». Organic Syntheses (en inglés) 94: 54-65. ISSN 2333-3553. doi:10.15227/orgsyn.094.0054. Consultado el 29 de abril de 2020.
- ↑ Trost, Barry M.; Fleming, Ian, 1935- (1991). Comprehensive organic synthesis : selectivity, strategy, and efficiency in modern organic chemistry (1st ed edición). Pergamon Press. ISBN 0-08-035929-9. OCLC 22908940. Consultado el 29 de abril de 2020.
- ↑ Ugi, I.; Werner, B.; Dömling, A. (2003/1). «The Chemistry of Isocyanides, their MultiComponent Reactions and their Libraries». Molecules (en inglés) 8 (1): 53-66. PMC 6146881. doi:10.3390/80100053. Consultado el 29 de abril de 2020.
- ↑ Overman, Larry E. (2005). Organic reactions. Wiley. ISBN 0-471-68260-8. OCLC 57355048. Consultado el 29 de abril de 2020.
- ↑ Pa, Tempest (2005 Nov). «Recent Advances in Heterocycle Generation Using the Efficient Ugi Multiple-Component Condensation Reaction». Current opinion in drug discovery & development (en inglés). Consultado el 29 de abril de 2020.
- ↑ Heck, I. Ugi and S. (31 de enero de 2001). «The Multicomponent Reactions and their Libraries for Natural and Preparative Chemistry». Combinatorial Chemistry & High Throughput Screening (en inglés). doi:10.2174/1386207013331291. Consultado el 29 de abril de 2020.
- ↑ Bienaymé, Hugues; Hulme, Chris; Oddon, Gilles; Schmitt, Philippe (15 de septiembre de 2000). «Maximizing Synthetic Efficiency: Multi-Component Transformations Lead the Way». Chemistry – A European Journal 6 (18): 3321-3329. ISSN 0947-6539. doi:10.1002/1521-3765(20000915)6:183.0.CO;2-A. Consultado el 29 de abril de 2020.
- ↑ Dömling, Alexander; Ugi, Ivar (2000). «Multicomponent Reactions with Isocyanides». Angewandte Chemie International Edition (en inglés) 39 (18): 3168-3210. ISSN 1521-3773. doi:10.1002/1521-3773(20000915)39:183.0.CO;2-U. Consultado el 29 de abril de 2020.
- ↑ Wang, Qian; Wang, De-Xian; Wang, Mei-Xiang; Zhu, Jieping (15 de mayo de 2018). «Still Unconquered: Enantioselective Passerini and Ugi Multicomponent Reactions». Accounts of Chemical Research 51 (5): 1290-1300. ISSN 0001-4842. doi:10.1021/acs.accounts.8b00105. Consultado el 29 de abril de 2020.
- ↑ Zhang, Jian; Yu, Peiyuan; Li, Shao-Yu; Sun, He; Xiang, Shao-Hua; Wang, Jun (Joelle); Houk, Kendall N.; Tan, Bin (14 de septiembre de 2018). «Asymmetric phosphoric acid–catalyzed four-component Ugi reaction». Science (en inglés) 361 (6407). ISSN 0036-8075. PMID 30213886. doi:10.1126/science.aas8707. Consultado el 29 de abril de 2020.
- ↑ Denmark, Scott E.; Fan, Yu (1 de noviembre de 2005). «Catalytic, Enantioselective α-Additions of Isocyanides: Lewis Base Catalyzed Passerini-Type Reactions». The Journal of Organic Chemistry 70 (24): 9667-9676. ISSN 0022-3263. doi:10.1021/jo050549m. Consultado el 29 de abril de 2020.
- ↑ Ilyin, Alexei; Kysil, Volodymyr; Krasavin, Mikhail; Kurashvili, Irina; Ivachtchenko, Alexandre V. (1 de diciembre de 2006). «Complexity-Enhancing Acid-Promoted Rearrangement of Tricyclic Products of Tandem Ugi 4CC/Intramolecular Diels−Alder Reaction». The Journal of Organic Chemistry 71 (25): 9544-9547. ISSN 0022-3263. doi:10.1021/jo061825f. Consultado el 29 de abril de 2020.
- ↑ El Kaim, Laurent; Gizolme, Marie; Grimaud, Laurence; Oble, Julie (1 de agosto de 2006). «Direct Access to Heterocyclic Scaffolds by New Multicomponent Ugi−Smiles Couplings». Organic Letters 8 (18): 4019-4021. ISSN 1523-7060. doi:10.1021/ol061605o. Consultado el 29 de abril de 2020.
- ↑ Bonnaterre, Florence; Bois-Choussy, Michèle; Zhu, Jieping (1 de septiembre de 2006). «Rapid Access to Oxindoles by the Combined Use of an Ugi Four-Component Reaction and a Microwave-Assisted Intramolecular Buchwald−Hartwig Amidation Reaction». Organic Letters 8 (19): 4351-4354. ISSN 1523-7060. doi:10.1021/ol061755z. Consultado el 29 de abril de 2020.
- ↑ Ma, Zhibo; Xiang, Zheng; Luo, Tuoping; Lu, Kui; Xu, Zhibin; Chen, Jiahua; Yang, Zhen (1 de septiembre de 2006). «Synthesis of Functionalized Quinolines via Ugi and Pd-Catalyzed Intramolecular Arylation Reactions». Journal of Combinatorial Chemistry 8 (5): 696-704. ISSN 1520-4766. doi:10.1021/cc060066b. Consultado el 29 de abril de 2020.
- ↑ Gedey, Szilvia; Van der Eycken, Johan; Fülöp, Ferenc (1 de mayo de 2002). «Liquid-Phase Combinatorial Synthesis of Alicyclic β-Lactams via Ugi Four-Component Reaction». Organic Letters 4 (11): 1967-1969. ISSN 1523-7060. doi:10.1021/ol025986r. Consultado el 29 de abril de 2020.
- ↑ Zhang, Jundong; Jacobson, Alan; Rusche, James R.; Herlihy, Walter (1 de febrero de 1999). «Unique Structures Generated by Ugi 3CC Reactions Using Bifunctional Starting Materials Containing Aldehyde and Carboxylic Acid». The Journal of Organic Chemistry 64 (3): 1074-1076. ISSN 0022-3263. doi:10.1021/jo982192a. Consultado el 29 de abril de 2020.
- ↑ Short, Kevin M.; Mjalli, Adnan M. M. (20 de enero de 1997). «A solid-phase combinatorial method for the synthesis of novel 5- and 6-membered ring lactams». Tetrahedron Letters (en inglés) 38 (3): 359-362. ISSN 0040-4039. doi:10.1016/S0040-4039(96)02303-9. Consultado el 29 de abril de 2020.
- ↑ Rossen, K.; Pye, P. J.; DiMichele, L. M.; Volante, R. P.; Reider, P. J. (17 de septiembre de 1998). «An efficient asymmetric hydrogenation approach to the synthesis of the Crixivan® piperazine intermediate». Tetrahedron Letters (en inglés) 39 (38): 6823-6826. ISSN 0040-4039. doi:10.1016/S0040-4039(98)01484-1. Consultado el 29 de abril de 2020.