Ley de Boyle-Mariotte
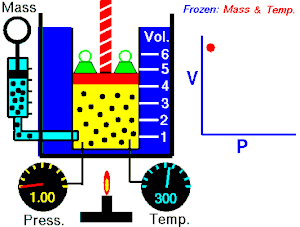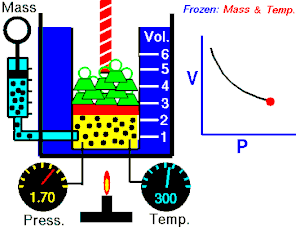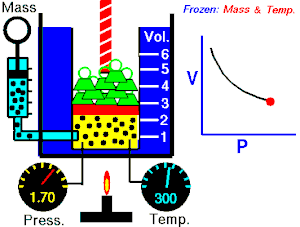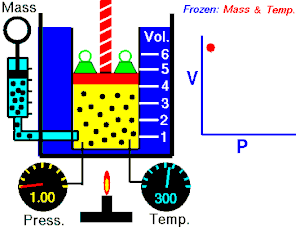
La ley de Boyle-Mariotte, o ley de Boyle, formulada independientemente por el físico y químico británico Robert Boyle en 1662 y el físico y botánico francés Edme Mariotte en 1676, es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante.
Introducción
La presión ejercida por una fuerza química es inversamente proporcional a la masa gaseosa, siempre y cuando su temperatura se mantenga constante (si el volumen aumenta la presión disminuye, y si el volumen disminuye la presión aumenta).
hay dos modelos que Boyle explicó sobre la relación entre gas y volumen.
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.
Matemáticamente se puede expresar así:
donde es constante si la temperatura y la masa del gas permanecen constantes.[1]
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta, No es necesario conocer el valor exacto de la constante para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Donde:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:
También conocido como la regla de tres
Esta ley es una simplificación de la Ley de los gases ideales particularizada para procesos isotérmicos de una cierta masa de gas constante.
Junto con la ley de Charles, la ley de Gay-Lussac, la ley de Avogadro y la ley de Graham, la ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal. Las tres primeras leyes pueden ser generalizadas en la ley de los gases ideales.
Experimento de Boyle
Para poder verificar su teoría, Mariotte introdujo un gas en un cilindro con un émbolo y comprobó las distintas presiones al bajar el émbolo.[2] A continuación hay una tabla que muestra algunos de los resultados obtenidos en este fenómeno siendo así:
Experimento de Mariotte × P (atm) V (L) P · V 0,5 60 30 1,0 30 30 1,5 20 30 2,0 15 30 2,5 12 30 3,0 10 30
Si se observan los datos de la tabla se puede comprobar que al aumentar la presión, el volumen disminuye. Por ello se usa una diagonal isotérmica para representarlo en una gráfica. aumenta y que al multiplicar y se obtiene .
Véase también
- Ley de los gases ideales
- Ley de Charles
- Ley de Gay-Lussac
- Ley general de los gases
- Ley de Avogadro
- Ley de Graham
- Gas ideal
Referencias
- ↑ Ercilla, Santiago Burbano de; Muñoz, Carlos Gracia (1 de enero de 2003). Física general. Editorial Tebar. ISBN 9788495447821. Consultado el 16 de febrero de 2017.
- ↑ Atkins, Peter William; Jones, Loretta (1 de enero de 2006). Principios de química: los caminos del descubrimiento. Ed. Médica Panamericana. ISBN 9789500600804. Consultado el 16 de febrero de 2017.
Bibliografía
- Greiner, Walter; Neise, Ludwig; Stöcker, Horst (1997). Thermodynamics and Statistical Mechanics, Springer. ISBN 0-3-87-94299-8.
- Levine, Ira N. (1978). Physical Chemistry', University of Brooklyn: Mcgraw-Hill.













