Inversión de Walden
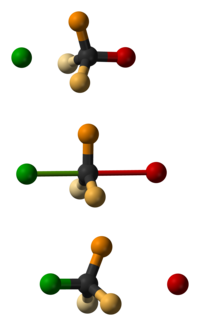
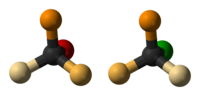
La inversión de Walden es la inversión de un centro quiral en una molécula, en el transcurso de una reacción química. Dado que una molécula puede formar dos enantiómeros en un centro quiral, la inversión de Walden convierte la configuración de la molécula de una forma enantiomérica a la otra. Por ejemplo, en una reacción SN2, la inversión de Walden se da en un átomo de carbono tetraédrico. Puede ser visualizado imaginando un paraguas que se invierte debido a un ventarrón.
Fue observada por primera vez por el químico Paul Walden en 1896. Él pudo convertir un enantiómero de un compuesto químico en el otro enantiómero y transformarlo nuevamente en el original, en un ciclo de Walden, que iba así: ácido (+)-clorosuccínico (1 en el esquema 1) era convertido a ácido (+)-málico 2 por la acción del óxido de plata en agua, con retención de la configuración; en el siguiente paso el grupo hidroxilo era reemplazado por cloro, generando el otro isómero del ácido clorosuccínico 3 por reacción con pentacloruro de fósforo; una segunda reacción con óxido de plata producía ácido (-)-málico 4, y finalmente una segunda reacción con PCl5 regresaba el ciclo a su punto inicial.[1]
En esta reacción, en el primer paso, el óxido de plata actúa como un donante de hidróxido, y la plata no juega un rol real. Los intermediarios son el dianión carboxilo A, que produce una sustitución nucleofílica intramolecular a una anillo de β-lactona B. El otro grupo carboxilo también es reactivo, pero la información in silico muestra que el estado de transición para la formación de la α-lactama es muy alta. Un ion hidroxilo abre el anillo de lactama hacia el alcohol C, y el efecto neto de dos inversiones es la retención de la configuración.[2]
Ver
- Otra demostración del ciclo de Walden en la transposición de Brook.
Referencias
- ↑ P. Walden (1896). «Ueber die gegenseitige Umwandlung optischer Antipoden». Berichte der deutschen chemischen Gesellschaft 29 (1): 133-138. doi:10.1002/cber.18960290127.
- ↑ The Walden cycle revisited: a computational study of competitive ring closure to α- and β-lactones J. Grant Buchanan, Richard A. Diggle, Giuseppe D. Ruggiero and Ian H. Williams Chemical Communications, 2006, 1106 - 1108 Abstract.

