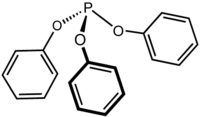
Fosfito de trifenilo
| Fosfito de trifenilo | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Fosfito de trifenilo[1] | ||
| General | ||
| Otros nombres | Trifenil fosfito; Trifenoxifosfina. | |
| Fórmula semidesarrollada | P(OC6H5)3 | |
| Fórmula molecular | C18H15O3P | |
| Identificadores | ||
| Número CAS | 101-02-0[2] | |
| ChEMBL | CHEMBL1875503 | |
| ChemSpider | 7259 | |
| PubChem | 7540 | |
| UNII | 9P45GRD24X | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 1184 kg/m³; 1,184 g/cm³ | |
| Masa molar | 310 284 g/mol | |
| Punto de fusión | 22 °C (295 K) | |
| Punto de ebullición | 360 °C (633 K) | |
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El fosfito de trifenilo es un compuesto organofosforado con la fórmula P(OC6H5)3, a menudo abreviado como P(OPh)3. Es un líquido incoloro con un olor muy picante. Se utiliza como ligando en química organometálica y como reactivo en síntesis orgánica. La molécula presenta un centro piramidal de fósforo (III) unido a tres grupos fenóxido.
Síntesis y reactividad[editar]
El fosfito de trifenilo se prepara a partir de tricloruro de fósforo en presencia de una base, típicamente una amina terciaria:
En ausencia de una base, produce difenilfosfito.
La trimetilfosfina se prepara a partir de trifenilfosfito:[3]
El trifenilfosfito es un ejemplo notable de poliamorfismo en compuestos orgánicos, es decir, existe en dos formas amorfas diferentes a temperaturas de aproximadamente 200 K.[4] No hace mucho, se obtuvo una nueva modificación polimórfica del fosfito de trifenilo mediante cristalización en líquidos iónicos.[5]
Complejos de coordinación representativos[editar]
El trifenilfosfito forma complejos de valencia cero del tipo M[P(OC6H5)3]4 para M = Ni, Pd, Pt. El complejo de níquel incoloro (punto de fusión 147 °C) puede prepararse a partir del complejo de níquel(0) con 1,5-ciclooctadieno:[6]
También forma una variedad de complejos de Fe(0) y Fe(II), como el dihidruro H2Fe[P(OC6H5)3]4.[7]
Referencias[editar]
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 931. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ↑ Número CAS
- ↑ Leutkens, Jr., M. L.; Sattelberger, A. P.; Murray, H. H.; Basil, J. D.; Fackler, Jr., J. P. "Trimethylphosphine" Inorganic Syntheses, 1990, volume 28, pages 305-310. ISBN 0-471-52619-3
- ↑ Ha, Alice; Cohen, Itai; Zhao, Xiaolin; Lee, Michelle; Kivelson, Daniel (1996). «Supercooled Liquids and Polyamorphism†». The Journal of Physical Chemistry 100: 1-4. doi:10.1021/jp9530820.
- ↑ D.G. Golovanov, K.A. Lyssenko, M.Yu. Antipin, Ya.S. Vygodskii, E.I. Lozinskaya, A.S. Shaplov. ”Long-awaited polymorphic modification of triphenyl phosphite“, Cryst. Eng. Comm., 2005, v. 7, no. 77, P.465 – 468. doi: 10.1039/b505052a
- ↑ Ittel, S. D. "Olefin, Acetylene, Phosphine, Isocyanide, and Diazene Complexes of Nickel(0)" Inorganic Syntheses, 1977, volume XVII, p. 117–124. ISBN 0-07-044327-0,
- ↑ Gerlach, D. H.; Peet, W. G.; Muetterties, E. L. (1972). «Stereochemically nonrigid six-coordinate molecules. II. Preparations and reactions of tetrakis(organophosphorus)metal dihydride complexes». Journal of the American Chemical Society 94 (13): 4545. doi:10.1021/ja00768a022.



![{\displaystyle {\rm {Ni(COD)_{2}+4\ P(OC_{6}H_{5})_{3}\rightarrow Ni[P(OC_{6}H_{5})_{3}]_{4}+2\ COD}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8a8db6d41ba7a3b56acb756575c946f37fa20754)