Fisetina
| Fisetina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 2-(3,4-dihydroxyphenyl)-3,7-dihydroxychromen-4-one | ||
| General | ||
| Otros nombres |
Cotinin (not to be confused with Cotinine) 5-Deoxyquercetin Superfustel Fisetholz Fietin Fustel Fustet Viset Junger fustik | |
| Fórmula estructural |
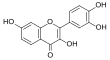 | |
| Fórmula molecular | C15H10O6 | |
| Identificadores | ||
| Número CAS | 528-48-3[1] | |
| ChEBI | 42567 | |
| ChEMBL | 31574 | |
| ChemSpider | 4444933 | |
| DrugBank | DB07795 | |
| PubChem | 5281614 | |
| UNII | OO2ABO9578 | |
| KEGG | C10041 | |
|
O=C1c3c(O/C(=C1/O)c2ccc(O)c(O)c2)cc(O)cc3
| ||
| Propiedades físicas | ||
| Densidad | 1,688 kg/m³; 0,001688 g/cm³ | |
| Masa molar | 286,2363 g/mol | |
| Punto de fusión | 330 °C (603 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La fisetina (3, 7, 3′, 4′-tetrahydroxyflavona) es un flavonol, una sustancia química que pertenece a los flavonoides, grupo de polifenoles. Se puede encontrar en muchas plantas, donde sirve como un agente colorante. También se encuentra en muchas frutas y verduras, como las fresas, manzanas, caquis, cebollas y pepinos.[2] Su fórmula química fue descrita por primera vez por el químico austríaco Josef Herzig en 1891.[3]
Fuentes biológicas[editar]
Fisetina se puede encontrar en una amplia variedad de plantas. Se encuentra en las eudicotiledóneas, tales como árboles y arbustos en la familia Fabaceae, como las acacias Acacia greggii[4] y Acacia berlandieri,[4] (Butea frondosa), (Gleditsia triacanthos), miembros de la familia Anacardiaceae tales como Quebracho colorado y especies del género Rhus, que contiene los zumaques.[5] Junto con miricetina, fisetina proporciona el color del colorante amarillo tradicional, que se extrajo de Rhus cotinus. Muchas frutas y verduras también contienen fisetina,[6] incluyendo fresas[7][8] manzanas,[8] y las uvas.[9] fisetina puede ser extraído de la fruta y de las fuentes de hierbas en jugos, vinos,[10] e infusiones como el té.[11] es también encontraron en monocotiledóneas como las cebollas.[8] También está presente en especies de Pinophyta como el ciprés amarillo ( Callitropsis nootkatensis ).
Propiedades[editar]
Diluido en una solución de etóxido de sodio, fisetina tiene una fluorescencia de color verde oscuro.
Efectos biológicos[editar]
Fisetina es ligeramente tóxica y potencialmente mutagénica.[cita requerida] Sin embargo, reduce la toxicidad de las aflatoxinas.[cita requerida]
Las aplicaciones médicas[editar]
La fisetina es un potente activador de las sirtuinas.[12] Por lo tanto, es un potente mimética de la restricción calórica, actuando así en contra de los efectos del envejecimiento.
Un estudio de P. Maher et al. muestra que fisetina tiene también un efecto beneficioso sobre la memoria a largo plazo.[13]
Un nuevo estudio realizado por P. Maher et al. en ratones Akita (genéticamente predispuestos a la diabetes ) muestran que una dieta rica en fresas (una fruta rica en fisetina) reduce los síntomas de la diabetes y está relacionado con la inflamación del cáncer.[14]
Referencias[editar]
- ↑ Número CAS
- ↑ Sahu, Bidya Dhar; Kalvala, Anil Kumar; Koneru, Meghana; Kumar, Jerald Mahesh; Kuncha, Madhusudana; Rachamalla, Shyam Sunder; Sistla, Ramakrishna (3 de septiembre de 2014). «Ameliorative Effect of Fisetin on Cisplatin-Induced Nephrotoxicity in Rats via Modulation of NF-κB Activation and Antioxidant Defence». PLoS One 9 (9). doi:10.1371/journal.pone.0105070.
- ↑ Herzig, J. (1891). «Studien über Quercetin und seine Derivate, VII. Abhandlung» [Studies on Quercetin and its Derivatives, Treatise VII]. Monatshefte für Chemie (en alemán) 12 (1): 177-90. doi:10.1007/BF01538594.
- ↑ a b Forbes TDA, Clement BA. «Chemistry of Acacia's from South Texas» (PDF). Texas A&M Agricultural Research and Extension Center at. Archivado desde el original el 26 de marzo de 2009. Consultado el 14 de abril de 2010.
- ↑ Gábor, M.; Eperjessy, E. (1966). «Antibacterial Effect of Fisetin and Fisetinidin». Nature 212 (5067): 1273. PMID 21090477. doi:10.1038/2121273a0.
- ↑ Fiorani, M.; Accorsi, A. (2005). "Dietary flavonoids as intracellular substrates for an erythrocyte trans-plasma membrane oxidoreductase activity". The British journal of nutrition 94 (3): 338–345. doi:10.1079/bjn20051504. PMID 16176603.
- ↑ Maher, Pamela; Dargusch, Richard; Ehren, Jennifer L.; Okada, Shinichi; Sharma, Kumar; Schubert, David (2011). «Fisetin Lowers Methylglyoxal Dependent Protein Glycation and Limits the Complications of Diabetes». En Deli, Maria A., ed. PLoS ONE 6 (6): e21226. PMC 3124487. PMID 21738623. doi:10.1371/journal.pone.0021226. Resumen divulgativo – ScienceDaily (June 28, 2011).
- ↑ a b c Arai, Y.; Watanabe, S.; Kimira, M.; Shimoi, K.; Mochizuki, R.; Kinae, N. (2000). "Dietary intakes of flavonols, flavones and isoflavones by Japanese women and the inverse correlation between quercetin intake and plasma LDL cholesterol concentration". The Journal of nutrition 130 (9): 2243–2250. PMID 10958819.
- ↑ Arai, Y.; Watanabe, S.; Kimira, M.; Shimoi, K.; Mochizuki, R.; Kinae, N. (2000). "Dietary intakes of flavonols, flavones and isoflavones by Japanese women and the inverse correlation between quercetin intake and plasma LDL cholesterol concentration". The Journal of nutrition 130 (9): 2243–2250. PMID 10958819.
- ↑ De Santi, C.; Pietrabissa, A.; Mosca, F.; Pacifici, G. M. (2002). "Methylation of quercetin and fisetin, flavonoids widely distributed in edible vegetables, fruits and wine, by human liver". International journal of clinical pharmacology and therapeutics 40 (5): 207–212. PMID 12051572.
- ↑ Viñas, P.; Martínez-Castillo, N.; Campillo, N.; Hernández-Córdoba, M. (2011). "Directly suspended droplet microextraction with in injection-port derivatization coupled to gas chromatography–mass spectrometry for the analysis of polyphenols in herbal infusions, fruits and functional foods". Journal of Chromatography A 1218 (5): 639–646. doi:10.1016/j.chroma.2010.12.026. PMID 21185565.
- ↑ David A. Sinclair et al. Descubra tres clases de moléculas que activen sirtuinas (Incluyendo Resveratrol)
- ↑ P. Maher et al.: “Flavonoid fisetin promotes ERK-dependent long-term potentiation and enhances memory”. Proceedings of the National Academy of Sciences of the United States of America 103 (44) (2006), pp. 16568-16573. PMID 17050681
- ↑ Fisetin Lowers Methylglyoxal Dependent Protein Glycation and Limits the Complications of Diabetes, P. Maher & al., 2011
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Fisetin» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
