Diferencia entre revisiones de «Asparagina»
Sin resumen de edición |
m Revertidos los cambios de 188.153.13.242 a la última edición de CEM-bot |
||
| Línea 1: | Línea 1: | ||
{{Ficha de compuesto químico |
|||
Ma guarda se si doveva proprio fare in spagnolo...-.- SPAGNOLO TI ODIOOOO era la pagina xfetta ma...ecco lo spagnolo-.- ma v********o XDciao{{Ficha de compuesto químico |
|||
|IUPAC= Ácido 2-amino-3-carbamoilpropanoico |
|IUPAC= Ácido 2-amino-3-carbamoilpropanoico |
||
|imagen=[[Archivo:L-asparagine-skeletal.png|150px|Estructura química]][[Archivo:L-asparagine-3D-sticks.png|150px|Modelo tridimensional]] |
|imagen=[[Archivo:L-asparagine-skeletal.png|150px|Estructura química]][[Archivo:L-asparagine-3D-sticks.png|150px|Modelo tridimensional]] |
||
Revisión del 18:39 14 abr 2010
| Asparagina | ||
|---|---|---|
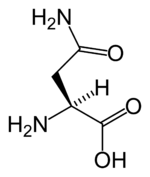  | ||
| Nombre IUPAC | ||
| Ácido 2-amino-3-carbamoilpropanoico | ||
| General | ||
| Símbolo químico | Asn, N | |
| Fórmula estructural |
 | |
| Fórmula molecular | C4H8N2O3 | |
| Identificadores | ||
| Número CAS | 70-47-3[1] | |
| ChEBI | 22653 | |
| ChemSpider | 231 | |
| PubChem | 236 | |
| KEGG | C16438 | |
|
N[C@@H](CC(N)=O)C(O)=O
| ||
| Propiedades físicas | ||
| Densidad | 1000 kg/m³; 1 g/cm³ | |
| Masa molar | 13 212 g/mol | |
| Punto de fusión | 508 K (235 °C) | |
| Propiedades químicas | ||
| Acidez | 2,16; 8,73 pKa | |
| Familia | Aminoácido | |
| Esencial | No | |
| Codón | AUU, AAC | |
| Punto isoeléctrico (pH) | 5,41 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La asparagina (abreviada como Asn o N) es uno de los 20 aminoácidos codificados en el código genético. Tiene un grupo carboxamida como su cadena lateral o grupo funcional. En el ser humano no es un aminoácido esencial. Los codones que la codifican son AAU y AAC.[2]
Una reacción entre la asparagina y un azúcar reductor o carbonilo reactivo produce acrilamida (amida acrílica) en los alimentos cuando son calentados a temperatura suficientemente alta. Estos productos están presentes en frituras, como papas al hilo, en hojuelas, y café tostado.
Historia
La asparagina fue aislada por primera vez en 1806 a partir del jugo del espárrago, en el que abunda, convirtiéndose en el primer aminoácido en ser aislado. El olor característico de la orina de los individuos después del consumo de espárrago es atribuido a varios subproductos metabólicos de la asparagina.
El nombre asparagina proviene del inglés, asparagine, derivado de asparagus, espárrago. Se suele utilizar los nombres asparragina y asparraguina, más fieles al origen del nombre, que siguiendo la misma lógica, debió haber sido esparraguina, en español.
Función estructural en las proteínas
Dado que la cadena lateral de asparagina puede formar interacciones de enlaces de hidrógeno con el esqueleto del péptido, los residuos de asparagina suelen ser encontrados al principio y al final de la estructura de hélice alfa, y en vueltas o asas en láminas beta. Se cree que su rol es acaparar las interacciones de enlace de hidrógeno que de otro modo estarían satisfechas por el esqueleto del polipéptido. La glutamina, con un grupo metileno extra, tiene mayor entropía conformacional y en consecuencia es menos útil en este sentido.
La asparagina también provee sitios clave para la N-glicosilación, una modificación de la cadena de proteína con la adición de cadenas de carbohidratos.
Fuentes
Fuentes dietarias
La asparagina no es un aminoácido esencial, lo que significa que puede ser sintetizado a apatir de intermediarios de ruta metabólica principal en humanos y no se requiere en la dieta. La asparagina se encuentra en:
- Fuentes animales: productos lácteos y suero lácteo, carne de ternera, aves de corral, huevos, pescado y marisco.
- Fuentes vegetales: espárragos, patatas, legumbres (incluida la soja), frutos secos y semillas.
Biosíntesis
El precursor de la asparagina es el oxalacetato. El oxalacetato es convertido a aspartato usando una enzima transaminasa. La enzima transfiere el grupo amino del glutamato al oxalacetato, produciendo α-cetoglutarato y aspartato. La enzima asparagina sintasa produce asparagina, AMP, glutamato y pirofosfato a partir de aspartato, glutamina, y ATP. En la reacción de la sintasa de la asparagina, el ATP se usa para activar el aspartato, formando β-aspartil-AMP. La glutamina dona un grupo amonio, que reacciona con β-aspartil-AMP para formar asparagina y tres AMP.
Degradación
El aspartato es un aminoácido glucogénico. La L-asparginasa hidroliza al grupo amida para formar aspartato y amonio. Una transaminasa convierte el aspartato a oxalacetato que puede luego ser metabolizado en el ciclo del ácido cítrico o gluconeogénesis.
Función
El sistema nervioso requiere asparagina. También juega un papel importante en la síntesis de amoníaco.
Referencias
- ↑ Número CAS
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. «Nomenclature and Symbolism for Amino Acids and Peptides». Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado el 17 de mayo de 2007.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Asparagina.
Wikimedia Commons alberga una galería multimedia sobre Asparagina.- Computational Chemistry Wiki
- Asparagus Makes Your Pee Stink
 Wikcionario tiene definiciones y otra información sobre asparagina.
Wikcionario tiene definiciones y otra información sobre asparagina.
