Diferencia entre revisiones de «Orbital atómico»
m Revertidos los cambios de 82.130.212.58 (disc.) a la última edición de XalD |
|||
| Línea 108: | Línea 108: | ||
La tabla siguiente muestra todas las configuraciones orbitales para el hidrógeno, como funciones de onda, desde el 1''s'' al 7''s''. Los átomos polielectrónicos irían alojando sus electrones en dichos grupos de orbitales. |
La tabla siguiente muestra todas las configuraciones orbitales para el hidrógeno, como funciones de onda, desde el 1''s'' al 7''s''. Los átomos polielectrónicos irían alojando sus electrones en dichos grupos de orbitales. |
||
{| class="wikitable" |
|||
|- |
|||
! |
|||
! ''s'' (l=0) |
|||
! colspan="3" |''p'' (''l''=1) |
|||
! colspan="5" |''d'' (''l''=2) |
|||
! colspan="7" |''f'' (''l''=3) |
|||
|- |
|||
! |
|||
! m=0 |
|||
! m=0 |
|||
! colspan="2" |m=±1 |
|||
! m=0 |
|||
! colspan="2" |m=±1 |
|||
! colspan="2" |m=±2 |
|||
! m=0 |
|||
! colspan="2" |m=±1 |
|||
! colspan="2" |m=±2 |
|||
! colspan="2" |m=±3 |
|||
|- |
|||
! |
|||
! ''s'' |
|||
! ''p''<sub>''z''</sub> |
|||
! ''p''<sub>''x''</sub> |
|||
! ''p''<sub>''y''</sub> |
|||
! ''d''<sub>''z<sup>2</sup>''</sub> |
|||
! ''d''<sub>''xz''</sub> |
|||
! ''d''<sub>''yz''</sub> |
|||
! ''d''<sub>''xy''</sub> |
|||
! ''d''<sub>''x<sup>2</sup>-y<sup>2</sup>''</sub> |
|||
! ''f''<sub>''z<sup>3</sup>''</sub> |
|||
! ''f''<sub>''xz<sup>2</sup>''</sub> |
|||
! ''f''<sub>''yz<sup>2</sup>''</sub> |
|||
! ''f''<sub>''xyz''</sub> |
|||
! ''f''<sub>''z(x<sup>2</sup>-y<sup>2</sup>)''</sub> |
|||
! ''f''<sub>''x(x<sup>2</sup>-3y<sup>2</sup>)''</sub> |
|||
! ''f''<sub>''y(3x<sup>2</sup>-y<sup>2</sup>)''</sub> |
|||
|- |
|||
!n=1 |
|||
| [[Archivo:S1M0.png|50px]] |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
|- |
|||
!n=2 |
|||
| [[Archivo:S2M0.png|50px]] |
|||
| [[Archivo:P2M0.png|50px]] |
|||
| [[Archivo:P2M1.png|50px]] |
|||
| [[Archivo:P2M-1.png|50px]] |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
|- |
|||
!n=3 |
|||
| [[Archivo:S3M0.png|50px]] |
|||
| [[Archivo:P3M0.png|50px]] |
|||
| [[Archivo:P3M1.png|50px]] |
|||
| [[Archivo:P3M-1.png|50px]] |
|||
| [[Archivo:D3M0.png|50px]] |
|||
| [[Archivo:D3M1.png|50px]] |
|||
| [[Archivo:D3M-1.png|50px]] |
|||
| [[Archivo:D3M2.png|50px]] |
|||
| [[Archivo:D3M-2.png|50px]] |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
| |
|||
|- |
|||
!n=4 |
|||
| [[Archivo:S4M0.png|50px]] |
|||
| [[Archivo:P4M0.png|50px]] |
|||
| [[Archivo:P4M1.png|50px]] |
|||
| [[Archivo:P4M-1.png|50px]] |
|||
| [[Archivo:D4M0.png|50px]] |
|||
| [[Archivo:D4M1.png|50px]] |
|||
| [[Archivo:D4M-1.png|50px]] |
|||
| [[Archivo:D4M2.png|50px]] |
|||
| [[Archivo:D4M-2.png|50px]] |
|||
| [[Archivo:F4M0.png|40px]] |
|||
| [[Archivo:F4M1.png|40px]] |
|||
| [[Archivo:F4M-1.png|40px]] |
|||
| [[Archivo:F4M2.png|40px]] |
|||
| [[Archivo:F4M-2.png|40px]] |
|||
| [[Archivo:F4M3.png|40px]] |
|||
| [[Archivo:F4M-3.png|40px]] |
|||
|- |
|||
!n=5 |
|||
| [[Archivo:S5M0.png|50px]] |
|||
| [[Archivo:P5M0.png|50px]] |
|||
| [[Archivo:P5M1.png|50px]] |
|||
| [[Archivo:P5M-1.png|50px]] |
|||
| [[Archivo:D5M0.png|50px]] |
|||
| [[Archivo:D5M1.png|50px]] |
|||
| [[Archivo:D5M-1.png|50px]] |
|||
| [[Archivo:D5M2.png|50px]] |
|||
| [[Archivo:D5M-2.png|50px]] |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
|- |
|||
!n=6 |
|||
| [[Archivo:S6M0.png|50px]] |
|||
| [[Archivo:P6M0.png|50px]] |
|||
| [[Archivo:P6M1.png|50px]] |
|||
| [[Archivo:P6M-1.png|50px]] |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
|- |
|||
!n=7 |
|||
| [[Archivo:S7M0.png|50px]] |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
| '''. . .''' |
|||
|- |
|||
|} |
|||
<center>[[Archivo:Orbitales_f.jpg]]</center> |
|||
== Véase también == |
== Véase también == |
||
Revisión del 11:23 24 nov 2009

Introducción
Un orbital atómico es la descripción ondulatoria del tamaño, forma y orientación de una región del espacio disponible para un electrón[1]. Cada orbital presenta una energía específica para el estado del electrón.
La posición (la probabilidad de la amplitud) de encontrar un electrón en un punto determinado del espacio se define mediante sus coordenadas en el espacio. En coordenadas cartesianas dicha probabilidad se denota como ψ(x, y, z), donde ψ no se puede medir directamente.
En realidad ψ es una herramienta matemática. En términos de coordenadas esféricas, ψ se expresa como ψ(r, θ, φ). Dada la simetría esférica de los átomos, dichas coordenadas se usan, de manera muy frecuente, en cálculos de funciones de onda para las descripción de los electrones y sus estados energéticos en los mismos.
El significado de dichas coordenadas es el siguiente:
- r es la distancia radial de cualquier punto del espacio al origen de coordenadas
- θ, es el ángulo entre el radio vector r y el eje z
- φ es el ángulo entre el eje x y la proyección del radio vector con el plano xy.
Las relaciones entre los dos sistemas de coordenadas son:
- x = r sen θ cos φ
- y = r sen θ sin φ
- z = r cos θ
La función de ondas
En el modelo atómico surgido tras la aplicación de la Mecánica Cuántica a la descripción de los electrones en los átomos (modelo posterior al átomo de Bohr[2], y en general en química, se denomina orbital atómico a cada una de las funciones de onda monoelectrónicas que describen los estados estacionarios de los átomos hidrogenoides (son las funciones de onda Ψ que se obtienen resolviendo la ecuación de Schrödinger independiente del tiempo HΨ = EΨ, es decir, las funciones propias del Hamiltoniano, H).
No representan la posición concreta de un electrón en el espacio, que no puede conocerse dada su naturaleza mecanocuántica, sino que representan una región del espacio en torno al núcleo atómico en la que la probabilidad de encontrar al electrón es elevada (por lo que en ocasiones al orbital se le llama Región espacio energética de manifestación probabilística electrónica o REEMPE).
El nombre que se asigna a las distintas clases de orbitales se debe a su relación con las lineas del espectro de un elemento (en inglés s sharp, p principal, d diffuse y f fundamental y el resto de los nombres, a partir de aquí, siguen el orden alfabético g, h ).
Los números cuánticos
En el caso del átomo de hidrógeno, Schrödinger pudo resolver la ecuación anterior de forma exacta, encontrando que las funciones de onda están determinadas por los valores de tres números cuánticos n, l, ml, es decir, para poder solucionar dicha ecuación hace falta introducir una serie de restricciones cuyos valores coinciden con los valores de los números cuánticos.
Posteriormente se introdujo la necesidad de incluir el espín del electrón que viene descrito por otros dos números cuánticos s y ms.
- El valor del número cuántico n (número cuántico principal, toma valores 1,2,3...) define el tamaño del orbital. Cuanto mayor sea, mayor será el volumen. También es el que tiene mayor influencia en la energía del orbital.
- El valor del número cuántico l (número cuántico del momento angular) indica la forma del orbital y el momento angular. El momento angular viene dado por:
La notación (procedente de la espectroscopia) es la siguiente:
- Para l = 0, orbitales s
- Para l = 1, orbitales p
- Para l = 2, obitales d
- Para l = 3, orbitales f
- Para l = 4, orbitales g; siguiéndose ya el orden alfabético.
- El valor de ml (número cuántico magnético) define la orientación espacial del orbital frente a un campo magnético externo. Para la proyección del momento angular frente al campo externo, se verifica:
- El valor de s (número cuántico de espín) para el electrón es 1/2, mientras que ms puede tomar los valores +1/2 ó -1/2 (cuando no se tiene en cuenta el espín se dice que el orbital es un orbital espacial mientras que si se considera el espín, se denomina espín orbital).
La función de onda se puede descomponer, empleando como sistema de coordenadas las coordenadas esféricas, de la siguiente forma:
donde
- Rn, l (r) representa la parte del orbital que depende de la distancia del electrón al núcleo y
- Θl, ml (θ) Φml (φ) la parte que depende de los ángulos (geometría) del orbital.
Para la representación gráfica del orbital se emplea la función cuadrado, |Θl, ml (θ)|² |Φml (φ)|², ya que ésta es proporcional a la densidad de carga y por tanto a la densidad de probabilidad, es decir, el volumen que encierra la mayor parte de la probabilidad de encontrar al electrón o, si se prefiere, el volumen o región del espacio en la que el electrón pasa la mayor parte del tiempo.
Más allá del átomo de hidrógeno
En sentido estricto, los orbitales son construcciones matemáticas que tratan de describir, de forma coherente con la mecánica cuántica, los estados estacionarios de un electrón en un campo eléctrico de simetría central. (Dado que el núcleo no está descrito de forma explícita, ni siquiera describen de forma completa al átomo de hidrógeno).
Estas construcciones matemáticas no están preparadas, por su origen monoelectrónico, para tener en cuenta ni la correlación entre electrones ni la antisimetría exigida por la estadística de Fermi (los electrones son fermiones).
Sin embargo, saliéndose de su sentido estricto, han demostrado ser de enorme utilidad para los químicos, de forma que se utilizan no solo para sistemas polielectrónicos, sino también para sistemas polinucleares (como las moléculas). También, más allá de su sentido estricto, los químicos se refieren a ellos como entes físicos más que como construcciones matemáticas, con expresiones como "en un orbital caben dos electrones".
Formas de los orbitales
Por simplicidad, se recogen las formas de la parte angular de los orbitales, obviando los nodos radiales, que siempre tienen forma esférica.
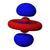
Orbital s
El orbital s tiene simetría esférica alrededor del núcleo atómico. En la figura siguiente se muestran dos formas alternativas de representar la nube electrónica de un orbital s: en la primera, la probabilidad de encontrar al electrón (representada por la densidad de puntos) disminuye a medida que nos alejamos del centro; en la segunda, se representa el volumen esférico en el que el electrón pasa la mayor parte del tiempo.

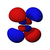
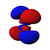
Orbital p
La forma geométrica de los orbitales p es la de dos esferas achatadas hacia el punto de contacto (el núcleo atómico) y orientadas según los ejes de coordenadas. En función de los valores que puede tomar el tercer número cuántico ml (-1, 0 y 1) se obtienen los tres orbitales p simétricos respecto a los ejes x, z e y. Análogamente al caso anterior, los orbitales p presentan n-2 nodos radiales en la densidad electrónica, de modo que al incrementarse el valor del número cuántico principal la probabilidad de encontrar el electrón se aleja del núcleo atómico. El orbital "p" representa también la energía que posee un electrón y se incrementa a medida que se aleja entre la distancia del núcleo y el orbital.

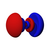
Orbital d
Los orbitales d tienen una forma más diversa: cuatro de ellos tienen forma de 4 lóbulos de signos alternados (dos planos nodales, en diferentes orientaciones del espacio), y el último es un doble lóbulo rodeado por un anillo (un doble cono nodal). Siguiendo la misma tendencia, presentan n-3 nodos radiales.

Orbital f
Los orbitales f tienen formas aún más exóticas, que se pueden derivar de añadir un plano nodal a las formas de los orbitales d. Presentan n-4 nodos radiales.
Tabla de orbitales
La tabla siguiente muestra todas las configuraciones orbitales para el hidrógeno, como funciones de onda, desde el 1s al 7s. Los átomos polielectrónicos irían alojando sus electrones en dichos grupos de orbitales.

Véase también
Referencias
- ↑ Milton Orchin,Roger S. Macomber, Allan Pinhas, and R. Marshall Wilson(2005)"Atomic Orbital Theory"
- ↑ Bohr, Niels (1913). «On the Constitution of Atoms and Molecules». Philosophical Magazine 26 (1): 476.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Orbital atómico.
Wikimedia Commons alberga una categoría multimedia sobre Orbital atómico.