Diferencia entre revisiones de «Configuración electrónica»
Sin resumen de edición |
m Revertidos los cambios de 190.82.227.56 a la última edición de 189.141.68.92 |
||
| Línea 1: | Línea 1: | ||
{{referencias}} |
{{referencias}} |
||
En [[Química Cuántica]], la ''' configuración electrónica''' es el modo en el cual los [[electrón|electrones]] están ordenados en un [[átomo]], [[molécula]] o en otra estructura física, de acuerdo con la [[aproximación orbital]] en la cual la función de onda del sistema se expresa como un [[determinante de Slater|producto de |
En [[Química Cuántica]], la ''' configuración electrónica''' es el modo en el cual los [[electrón|electrones]] están ordenados en un [[átomo]], [[molécula]] o en otra estructura física, de acuerdo con la [[aproximación orbital]] en la cual la función de onda del sistema se expresa como un [[determinante de Slater|producto de orbitales antisimetrizado]].<ref name="IUPAC1">{{GoldBookRef|file=C01248|title=configuration (electronic)}}</ref><ref>Glosario de términos usados en fotoquímica, Universitat Autònoma de Barcelona, Servei de Publicacions, Bellaterra, 1999. http://www.fotoquimica.org/esp/docs/glo.pdf</ref> |
||
Como los electrones son [[fermión|fermiones]] están sujetos al [[principio de exclusión de Pauli]], que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente. |
Como los electrones son [[fermión|fermiones]] están sujetos al [[principio de exclusión de Pauli]], que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente. |
||
Revisión del 22:48 4 may 2009
En Química Cuántica, la configuración electrónica es el modo en el cual los electrones están ordenados en un átomo, molécula o en otra estructura física, de acuerdo con la aproximación orbital en la cual la función de onda del sistema se expresa como un producto de orbitales antisimetrizado.[1][2] Como los electrones son fermiones están sujetos al principio de exclusión de Pauli, que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente.
En los átomos, los estados estacionarios de la función de onda de un electrón (los estados que son función propia de la ecuación de Schrödinger HΨ = EΨ en donde H es el hamiltoniano monoelectrónico correspondiente) se denominan orbitales atómicos, por analogía con la imagen clásica de los electrones orbitando alrededor del núcleo. Estos estados se pueden describir mediante cuatro números cuánticos: n, l, m y ms, y, en resumen, el principio de exclusión de Pauli implica que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales.
De acuerdo con este modelo, los electrones pueden pasar de un nivel de energía orbital a otro ya sea emitiendo o absorbiendo un cuanto de energía, en forma de fotón. Debido al principio de exclusión de Pauli, no más de dos electrones pueden ocupar el mismo orbital y, por tanto, la transición se produce a un orbital en el cual hay una vacante.
Valores de los números cuánticos
En el caso de los orbitales de los átomos hidrogenoides el número cuántico principal n está asociado a los diferentes niveles de energía orbital permitidos o niveles cuánticos; los valores que toma son 1, 2, 3, 4,... Para n=1 se tiene el nivel de menor energía. Todos los estados con el mismo número cuántico principal forman una capa (o nivel). Por razones históricas, estas capas electrónicas (por ejemplo en espectroscopia de rayos X) también se denotan como K, L, M, N,... El segundo número cuántico l corresponde al momento angular del estado. Estos estados tienen la forma de armónicos esféricos, y por lo tanto se describen usando polinomios de Legendre. También por razones históricas a estas subcapas (o subniveles), se les asigna una letra, que hace referencia al tipo de orbital que describe el estado electrónico (s, p, d, f, ...).
Los valores que puede tomar l son: 0, 1, 2, ..., (n-1), siendo n el número cuántico principal. El tercer número cuántico, m, puede tomar los valores desde -l a l, y por lo tanto hay un total de 2l+1 estados degenerados posibles. Cada uno de éstos puede ser ocupado por dos electrones con espines opuestos, consecuencia de los dos posibles valores de la proyección sobre el eje z del espín electrónico, ms, que puede tomar los valores +1/2 ó -1/2. Esto da un total de 2(2l+1) electrones en total (tal como se puede ver en la tabla anterior).
| Valor de l | Letra | Máximo número de electrones |
|---|---|---|
| 0 | s | 2 |
| 1 | p | 6 |
| 2 | d | 10 |
| 3 | f | 14 |
| Número cuántico | Valores posibles |
|---|---|
| n | 1, 2, 3,... |
| l | 0,..., (n-1) |
| m | -l,..., 0,....,+l (2l+1) |
| ms | -1/2, +1/2 |
Notación
En Física y Química se utiliza una notación estándar para describir las configuraciones electrónicas de átomos y moléculas. Para los átomos, la notación contiene la definición de los orbitales atómicos (en la forma n l, por ejemplo 1s, 2p, 3d, 4f) indicando el número de electrones asignado a cada orbital (o al conjunto de orbitales de la misma subcapa) como un superíndice. Por ejemplo, el hidrógeno tiene un electrón en el orbital s de la primera capa, de ahí que su configuración electrónica se escriba 1s1. El litio tiene dos electrones en la subcapa 1s y uno en la subcapa 2s (de mayor energía), de ahí que su configuración electrónica se escriba 1s2 2s1 (pronunciándose "uno-s-dos, dos-s-uno"). Para el fósforo (número atómico 15), tenemos: 1s2 2s2 2p6 3s2 3p3.
Para átomos con muchos electrones, esta notación puede ser muy larga por lo que se utiliza una notación abreviada, que tiene en cuenta que las primeras subcapas son iguales a las de algún gas noble. Por ejemplo, el fósforo, difiere del neón (1s2 2s2 2p6) únicamente por la presencia de la tercera capa. Así, la configuración electrónica del fósforo se puede escribir respecto de la del neón como: [Ne] 3s2 3p3. Esta notación es útil si tenemos en cuenta que la mayor parte de las propiedades químicas de los elementos vienen determinadas por las capas más externas.
El orden en el que se escriben los orbitales viene dado por la estabilidad relativa de los orbitales, escribiéndose primero aquellos que tienen menor energía orbital. Esto significa que, aunque sigue unas pautas generales, se pueden producir excepciones. La mayor parte de los átomos siguen el orden dado por la regla de Madelung. Así, de acuerdo con esta regla, la configuración electrónica del hierro se escribe como: [Ar] 4s2 3d6. Otra posible notación agrupa primero los orbitales con el mismo número cuántico n, de tal manera que la configuración del hierro se expresa como [Ar] 3d6 4s2 (agrupando el orbital 3d con los 3s y 3p que están implicitos en la configuración del argón).
El superíndice 1 de los orbitales ocupados por un único electrón no es obligatorio.[3] Es bastante común ver las letras de los orbitales escritas en letra itálica o cursiva. Sin embargo, la Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda utilizar letra normal, tal y como se realiza aquí.
Historia
Niels Bohr fue el primero en proponer (1923) que la periodicidad en las propiedades de los elementos se podía explicar mediante la estructura electrónica del átomo.[4] Su propuesta se basó en el modelo atómico de Bohr para el átomo, en el cual las capas electrónicas eran órbitas electrónicas a distancias fijas al núcleo. Las configuraciones originales de Bohr hoy parecen extrañas para el químico: al azufre se le asignaba una configuración 2.4.4.6 en vez de 1s2 2s2 2p6 3s2 3p4.
Un año después, E. C. Stoner incorpora el tercer número cuántico de la teoría de Sommerfeld en la descripción de las capas electrónicas, y predice correctamente la estructura de capas del azufre como 2.8.6.[5] Sin embargo, ni el sistema de Bohr ni el de Stoner podían describir correctamente los cambios del espectro atómico en un campo magnético (efecto Zeeman)
Bloques de la tabla periódica
Las propiedades químicas de un átomo dependen mucho de cómo están ordenados los electrones en los orbitales de más energía (a veces llamados de valencia), aparte de otros factores como el radio atómico, la masa atómica, o la accesibilidad de otros estados electrónicos.
Conforme se baja en un grupo de elementos, desde el más ligero al más pesado, los electrones más externos, en niveles del carbono y el plomo tienen cuatro electrones en sus orbitales más externos. Debido a la importancia de los niveles energéticos más exteriores, las distintas regiones de la tabla periódica se dividen en bloques, llamándolas según el último nivel ocupado: bloque s, bloque p, bloque d y bloque f, tal como se ve en el diagrama.
Regla de exclusion de Pauli
Esta regla nos dice que en un orbital o spin solo lo puede ocupar un electron es en este caso en donde sale lo de los valores del spin o giro de los electrones en el que son (-1/2). También de que en una orientación deben de caber dos electrones excepto cuando el número de electrones se han acabado por lo cual el orden que deben de seguir este ordenamiento es primero los de espin negativo (-1/2) y luego los positivos, esto es en cada nivel.
Regla del octeto
Para que un átomo sea estable debe tener todos sus orbitales llenos (cada orbital con dos electrones, uno de spin +1/2 y otro de spin -1/2) Por ejemplo, el oxígeno, que tiene configuración electrónica 1s², 2s², 2p4, debe llegar a la configuración 1s², 2s², 2p6 con la cual los niveles 1 y 2 estarían llenos. Recordemos que la Regla del octeto, justamente establece que el nivel electrónico se completa con 8 electrones, excepto el Hidrógeno, que se completa con 2 electrones. Entonces el oxígeno tendrá la tendencia a ganar los 2 electrones que le faltan, por esto se combina con 2 átomos de hidrógenos (en el caso del agua, por ejemplo), que cada uno necesita 1 electrón (el cual recibe del oxígeno) y otorga a dicho átomo 1 electrón cada uno. De este modo, cada hidrógeno completó el nivel 1 y el oxígeno completó el nivel 2.
En química se denomina orbital a la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima, cercana al 91%. Ejemplo de ello: 10Ne: 1s2, 2s2, 2p6 regla del octeto: 11Na:(Ne)10, 1s2, 2s2, 2p6, 3s2
Distribución electrónica
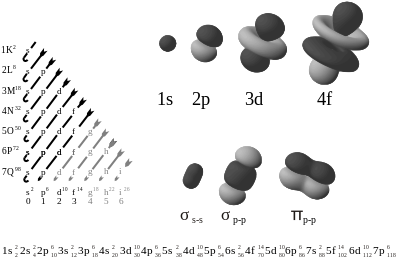
Es la distribución de los electrones en los subniveles y orbitales de un átomo. La configuración electrónica de los elementos se rige según el diagrama de Moeller:
1s/ 2s 2p/ 3s 3p 4s/ 3d 4p 5s/ 4d 5p 6s/ 4f 5d 6p 7s/ 5f 6d 7p/.
Ahora ya podemos utilizar el orden de energías de los orbitales para describir la estructura electrónica de los átomos de los elementos. Un subnivel s puede acomodarse 1 o 2 electrones. El subnivel p, puede acomodarse 1 a 6 electrones; el subnivel d de 1 a 10 electrones y el subnivel f de 1 a 14 electrones. Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan, primero, en los subniveles de menor energía, y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía más alto. El único electrón del átomo de hidrogeno se localiza en el subnivel S del primer nivel de energía. Un método abreviado para indicar la configuración electrónica es:
A esto se le llama notación de orbitales o subniveles e indica que hay un electrón en el subnivel s del primer nivel de energía. El núcleo de electrones en el subnivel se indica con el superíndice a la derecha del subnivel. Los 2 electrones del helio se encuentran en la posición de energía más baja, esto es, el subnivel s del primer nivel de energía.
Para determinar la configuración electrónica de un elemento, solo hay que decidir cuantos electrones hay que acomodar y entonces distribuirlos en los subniveles empezando con los de menor energía e ir llenando hasta que todos los electrones estén distribuidos. Un elemento con número atómico más grande tiene un electrón más que el elemento que lo precede. El subnivel de energía aumenta de esta manera:
- Subnivel S, P, D ó F: Aumenta el nivel de energía.
Sin embargo, existen excepciones como ocurre en los elementos de transición al ubicarnos en los grupos del cromo y del cobre, en los que se promueve el electrón dando así una configuración fuera de lo común.
Véase también
Enlaces externos
- Configuraciones Electrónicas en tabla de Elementos Químicos para imprimir (muestra excepciones en letra cursiva)
Referencias
- ↑ Unión Internacional de Química Pura y Aplicada. «configuration (electronic)». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Glosario de términos usados en fotoquímica, Universitat Autònoma de Barcelona, Servei de Publicacions, Bellaterra, 1999. http://www.fotoquimica.org/esp/docs/glo.pdf
- ↑ La forma completa de la notación de la configuración electrónica representa un producto matemático, de ahí que 3p1 sea igual que 3p.
- ↑ Niels Bohr (1923). «Über die Anwendung der Quantumtheorie auf den Atombau. I. Die Grundpostulate der Quantentheorie». Z. Phys. 13: 117.
- ↑ E.C. Stoner (1924). «The distribution of electrons among atomic levels». Phil. Mag. (6th Ser.) 48: 719-36.
