Descelularización
La descelularización es el proceso usado en ingeniería biomédica para aislar la matriz extracelular (ECM) de un tejido de las células que lo habitan, dejando un andamio de ECM del tejido original, que puede ser utilizado en órganos artificiales y regeneración tisular. Los trasplantes de órganos y de tejido tratan una variedad de problemas médicos, que van desde la insuficiencia multiorgánica hasta la cirugía estética. Una de las mayores limitaciones para trasplante de órganos deriva del rechazo de órganos causado por la superficie celular de los anticuerpos en el órgano que se dona.[1] Debido a respuestas inmunes desfavorables, los pacientes de trasplantes tienen que conllevar una toma constante de medicamentos inmunosupresivos durante toda su vida. Stephen F. Badylak fue el primero en realizar investigaciones en el proceso de descelularización en el Instituto McGowan de Medicina Regenerativa en la Universidad de Pittsburgh.[2] Este proceso crea un biomaterial natural para que actúe como andamio para el crecimiento celular, la diferenciación celular y el crecimiento de tejidos. Al recelularizar un andamio de ECM con células propias del paciente, se elimina la respuesta inmunológica adversa. Hoy en día, están disponibles de manera comercial andamios de ECM para una amplia variedad de residuos. ingeniería de tejidos.
Con una amplia variedad de tratamientos inductores de descelularización disponible, las combinaciones de tratamientos físicos, químicos y enzimáticos son monitoreados cuidadosamente para asegurarse de que el andamio ECM mantiene la integridad estructural y química del tejido original.[2] Los científicos usan el andamio ECM adquirido para reproducir un órgano funcional al introducir células progenitoras o células madre adultas y permiténdoles diferenciarse en el andamio para desarrollarse y convertirse en el tejido deseado. El órgano o tejido producido puede ser trasplantado a un paciente. En contraste con los anticuerpos superficiales de la célula, los componentes bioquímicos del ECM se conservan entre hospederos y así se minimiza el riesgo de una respuesta inmune hostil.[3][4] La conservación adecuada de las fibras de la ECM, los factores de crecimiento y otras proteínas es imprescindible para que las células progenitoras puedan diferenciarse en las células adultas adecuadas. El éxito de descelularización varía en función de los componentes y la densidad del tejido aplicado y su origen.[5] Las aplicaciones para el método de decelularización de producir un biomaterial tipo andamio para la regeneración de los tejidos están presentes en tejidos cardiaco, cutáneo, pulmonar, renal, entre otros tipos de tejidos. El éxito a nivel de órgano todavía está en los primeras etapas.[6]
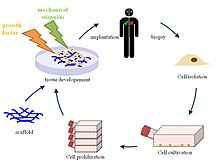
Resumen del proceso
Los investigadores son capaces de tomar el tejido de un donante o cadáver, lisar y matar a las células dentro del tejido sin dañar a los componentes extracelulares y al final terminar con un producto que es el andamio ECM natural que tiene las mismas funciones físicas y bioquímicas del tejido natural.[2] Después de adquirir el ECM, los científicos pueden recelularizar el tejido con células potentes o progenitoras para que se diferencíen en el tipo de tejido original. Al remover las células del tejido donante, los anticuerpos inmunogénicos del donante serán removidos. Las células progenitoras pueden ser tomadas del hospedero, por lo que no tendrán una respuesta adversa al tejido. Este proceso de descelularizar tejidos y órganos sigue desarrollándose, pero se le considera descelularización al proceso exacto de tomar un tejido de un donante y extraerle todos sus componentes celulares. Los pasos para ir de un andamio de ECM descelularizado a un órgano funcional está bajo el enfoque de la recelularización. Debido a las aplicaciones en diversos tipos de tejido en el cuerpo humano, las técnicas de descelularización tienen que ser adaptas para el tejido específico en el cual se ejercen. Los métodos investigados de descelularización incluyen tratamientos físicos, químicos y enzimáticos. Aunque hay métodos que se utilizan comúnmente, la combinacióm exacta de métodos varía dependiendo del origen del tejido y para qué se necesita.[5]
Para introducir químicos y enzimas en su forma líquida a un órgano o tejido, se han usado técnicas de descelularización de perfusión e inmersión. La descelularizacion por perfusión se puede aplicar cuando hay un gran sistema de vasculatura presente en el órgano o tejido. Es crucial que el andamio ECM esté descelularizado en todos los niveles, y de manera uniforme a lo largo de la estructura.[7] Debido a este requerimiento, se pueden perfundir químicos y enzimas a través de las arterias, venas y capilares presentes. Bajo este mecanismo y con las condiciones fisiológicas apropiadas, los tratamientos pueden difundir igualmente a todas las células dentro del órgano. Los tratamientos pueden ser removidos a través de las venas al final del proceso. La descelularización cardiaca y pulmonar usa este proceso frecuentemente para introducir los tratamientos gracias a sus redes altamente vascularizadas. La descelularización por inmersión se logra a través de la submersión de un tejido en tratamientos químicos y enzimáticos. Este proceso se logra más fácilmente que el de perfusión, pero está limitado a tejidos delgados con un sistema vascular limitado.
Tratamientos físicos
The most common physical methods used to lyse, kill, and remove cells from the matrix of a tissue through the use of temperature, force and pressure, and electrical disruption. Temperature methods are often used in a rapid freeze-thaw mechanism. By quickly freezing a tissue, microscopic ice crystals form around the plasma membrane and the cell is lysed.[8] After lysing the cells, the tissue can be further exposed to liquidized chemicals that degrade and wash out the undesirable components. Temperature methods conserve the physical structure of the ECM scaffold, but are best handled by thick, strong tissues.
Direct force of pressure to a tissue will guarantee disruption of the ECM structure, so pressure is commonly used. Pressure decellularization involves the controlled used of hydrostatic pressure applied to a tissue or organ. This is done best at high temperatures to avoid unmonitored ice crystal formation that could damage the scaffold. Electrical disruption of the plasma membrane is another option to lyse the cells housed in a tissue or organ. By exposing a tissue to electrical pulses, micropores are formed at the plasma membrane. The cells eventually turn to death after their homeostatic electrical balance is ruined through the applied stimulus. This electrical process is documented as Non-thermal irreversible electroporación (NTIRE) and is limited to small tissues and the limited possibilities of inducing an electrical current in vivo.[2]
Tratamientos químicos
La combinación adecuada de químicos para la descelularización es elegida dependiendo en el grosor, composición de matriz extracelular y uso pretendido del tejido u órgano. Por ejemplo, no se pueden usar enzimas en un tejido con colágeno porque interrumpirían las fibras de tejido conectivo. Sin embargo, cuando no hay altas concentraciones o necesidad de colágeno en el tejido, las enzimas pueden ser una opción viable para la descelularización. Los químicos utilizados para matar y remover las células incluyen ácidos, tratamientos alcalinos, detergentes iónicos, detergentes no iónicos y detergentes zwitteriónicos.
El detergente iónico, dodecilsulfato sódico es comúnmente utilizado debido a su alta eficacia para lisar las células sin causar daño significativo a la matriz extracelular. Los detergentes actúan para lisar la membrana celular y exponer los contenidos celulares para que puedan ser degradados. Después de que el SDS lisa la membrana células, las endonucleasas y exonucleasas degradan los contenidos genéticos, mientras que otros componentes de las células son solubilizados y enjuagados. Se usa comúnmente el SDS is aunque tiene una tendencia de modificar ligeramente la estructura de la matriz extracelular. Tratamientos ácidos y alcalinos pueden ser omplementos efectivos de un tratamiento con SDS por su habilidad de degradar ácidos nucleicosy solubilizar inclusiones citoplasmáticas.[5]
El detergente no iónico más conocido es el Triton X-100, el cual es popular debido a su habilidad para alterar las interacciones de los lípidos con otros lípidos y con proteínas. El Triton X-100 no interrumpe las interacciones entre proteínas, lo cual es benéfico ya que ayuda a mantener intacta a la matriz extracelular. El EDTA es un agente quelante que acepta calcio, el cual es un componente necesario para que las proteínas interactúen entre sí. Al dejar al calcio inaccesible, el EDTA previene que las proteínas integrales entre células se unan entre sí. Normalmente, el EDTA es acompañado con tripsina, una enzima que actúa como proteasa para cortar los enlaces ya existentes entre las proteínas integrales dentro del tejido. La combinación EDTA-tripsina es una buena opción para descelularizar tejidos.
Tratamientos enzimáticos
Enzymes used in decellularization treatments are used to break the bonds and interactions between nucleic acids, interacting cells through neighboring proteins, and other cellular components. lipasas, termolisina, galactosidasa, nucleasas, and tripsina have all ben used in the removal of cells. After a cell is lysed with a detergent, acid, physical pressure, etc., endonucleases and exonucleases can begin the degradation of the genetic material. Endonucleases cleave DNA and RNA in the middle of sequences. Benzoase, an endonuclease, produces multiple small nuclear fragments that can be further degraded and removed from the ECM scaffold.[9] Exonucleases act at the end of DNA sequences to cleave the phosphodiester bonds and further degrade the nucleic acid sequences.
Enzymes such as trypsin act as proteases that cleave the interactions between proteins. Although trypsin can have adverse affects of collagen and elastin fibers of the ECM, using it in a time-sensitive manner controls any potential damage it could cause on the extracellular fibers. Dispase is used to prevent undesired aggregation of cells, which is beneficial in promoting their separating from the ECM scaffold. Experimentation has shown dispase to be most effective on the surface of a thin tissue, such as a lung in pulmonary tissue regeneration. To successfully remove deep cells of a tissue with dispase, mechanical agitation is often included in the process.
Collagenase is only used when the ECM scaffold product does not require an intact collagen structure. Lipases are commonly used when decellularized skin grafts are needed. Lipase acids function in decellularizing dermal tissues through delipidation and cleaving the interactions between heavily lipidized cells. The enzyme, α-galactosidase is a relevant treatment when removing the Gal epitope antigen from cell surfaces.[5]
Aplicaciones
A natural ECM scaffold provides the necessary physical and biochemical environment to facilitate the growth and specialization of potent progenitor and stem cells. Acellular matrices have been isolated in vitro and in vivo in a number of different tissues and organs.[6] The most applicable success from decellularized tissues has come from symmetrical tissues that have less specialization, such as bone and dermal grafts; however, research and success is ongoing at the organ level.
Acellular dermal matrices have been successful in a number of different applications. For example, skin grafts are used in cosmetic surgery and burn care. The decellularized skin graft provides mechanical support to the damaged area while supporting the development of host-derived connective tissue. Cardiac tissue has clinical success in developing human valves from natural ECM matrices.[10] A procedure known as the ‘’’Ross Procedure’’’ uses an acellular heart valve to replace a defective valve, allowing native cells to repopulate a newly functioning valve. Decellularized allografts have been critical in bone grafts that function in bone reconstruction and replacing of deformed bones in patients.
The limits to myocardial tissue engineering come from the ability to immediately perfuse and seed and implemented heart into a patient. Though the ECM scaffold maintains the protein and growth factors of the natural tissue, the molecular level specialization has not yet been harnessed by researchers using decellularized heart scaffolds. Better success at using a whole organ from decellularization techniques has been found in pulmonary research. Scientists have been able to regenerate whole lungs in vitro from rat lungs using perfusion-decellularization. By seeding the matrix with fetal rat lung cells, a functioning lung was produced. The in vitro-produced lung was successfully implemented into a rat, which attests to the possibilities of traating an in vitro produced organ into a patient.
Other success for decellularization has been found in small intestinal submucosa (SIS), renal, and pancreatic engineering. Because is a thin material, the matrix can be produces through immersing the tissue in chemical and enzymatic treatments. Renal tissue engineering is still developing, but cadaveric kidney matrices have been able to support development of potent fetal kidney cells. Pancreatic engineering is a testament to the molecular specificity of organs. Scientists have not yet been able to produce an entirely functioning pancreas, but they have had success in producing an organ that functions at specific segments. For example, diabetes in rats was shown to decrease by seeding a pancreatic matrix at specific sites.[6] The future applications of decellularized tissue matrix is still being discovered and is considered one of the most hopeful areas in regenerative research.
Véase también
 Portal:Biología. Contenido relacionado con Biología.
Portal:Biología. Contenido relacionado con Biología.- Ingeniería de tejidos
- Rechazo de trasplantes
- Trasplante de órganos
Referencias
- ↑ Colaco, M., & Atala, A. The Future of Transplant Biology and Surgery. Interdisciplinary Medicine. (2014)
- ↑ a b c d Gilbert, Thomas W.; Sellaro, Tiffany L.; Badylak, Stephen F. (14 de febrero de 2006). «Decellularization of tissues and organs». Biomaterials 27: 3675-3683.
- ↑ Exposito, J.Y.; D'Alessio, M.; Solursh, M.; Ramirez, F. (1992). «Sea urchin collagen evolutionary homologous to vertebrate pro-alpha». J Biol Chem 267: 15559-62.
- ↑ Constantinou, C (1991). «Use of polymerase chain reaction and partially degenerate oligonucleotide for generation of novel cDNA clones.». Matrix 11: 1-9.
- ↑ a b c d Crapo, Peter M.; Gilbert, Thomas W.; Badylak, Stephen F. (15 de enero de 2011). «An overview of tissue and whole organ decellularization processes». Biomaterials 32: 3233-3243.
- ↑ a b c Song, Jeremy J.; Ott, Harald C. (agosto de 2011). «Organ engineering based on decellularized matrix scaffolds». Trends in Molecular Medicine 17 (8): 424-432.
- ↑ Ott, H.C (2008). «Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart.». Natural Medicine 14: 213-221.
- ↑ Flynn, L.E. (2010). «The use of decellularized adipose tissue to provide an inductive microenvironment for the adipogenic differentiation of human adipose-derived stem cells.». Biomaterials 31: 4715-4724.
- ↑ Petersen, T.H.; Calle, E.A.; Zhao, L.; Lee, E.J.; Gui, L.; Raredon, M.B. (2010). «Tissue-engineered lungs for in vivo implantation.». Science 329: 538-541.
- ↑ Zimmermann, W.H. (2004). «Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts». Natural Medicine 12: 452-458.
