Diferencia entre revisiones de «Expansión de anillo de Buchner»
Creado al traducir la página «Buchner ring expansion» |
(Sin diferencias)
|
Revisión del 11:54 18 dic 2019
Plantilla:ReactionboxPlantilla:Reactionbox
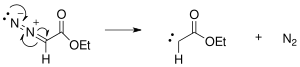
El Buchner expansión de anillo es una dos -dar un paso orgánico C-C conformación de vínculo la reacción utilizó para acceder 7-membered anillos. El primer paso implica formación de un de etilo diazoacetate, el cual cyclopropanates un anillo aromático. La expansión de anillo ocurre en el segundo paso, con un la reacción que abre el cyclopropane anillo para formar el 7-membered anillo. La expansión del anillo de Buchner es una reacción de formación de enlaces C-C orgánicos de dos pasos utilizada para acceder a los anillos de 7 miembros. El primer paso implica la formación de un carbeno a partir del diazoacetato de etilo, que ciclopropana un anillo aromático. La expansión del anillo ocurre en el segundo paso, con una reacción electrocíclica que abre el anillo de ciclopropano para formar el anillo de 7 miembros.

El Buchner reacción de expansión del anillo era primero utilizada en 1885 por E. Buchner Y T. Curtius Quién preparó un carbene de etilo diazoacetate para adición a benzene utilizando ambos térmico y fotoquímico pathways en la síntesis de cycloheptatriene derivados.[1][2] El producto resultante era una mezcla de cuatro isomeric ácidos carboxílicos. Las variaciones en la reacción surgen de métodos de carbene preparación. Avances en organometallic la química ha resultado en selectividad aumentada de cycloheptatriene derivados. En el @1980s esté encontrado que dirhodium los catalizadores proporcionan solos cyclopropane isómeros en cosechas altas.[3] Las aplicaciones están encontradas en medicina (síntesis de fármaco) y ciencia material (fullerene derivados).[4][5][6][7][8][9][10][11]
Buchner primera síntesis de cycloheptatriene derivados en 1885 utilizó photolysis y condiciones térmicas para generar el carbene. Un procedimiento para preparación del peligroso empezando material necesitado para carbene generación en el Buchner reacción, etilo-diazoacetate, es disponible en Síntesis Orgánicas.[12] En el procedimiento proporcionado, Searle incluye cautionary instrucciones debido a la naturaleza altamente explosiva de diazoacetic ésteres.
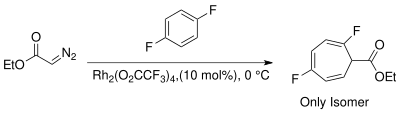
Síntesis del carbene en el @1960s estuvo centrado encima utilizando catalizadores cobrizos para stereoselective propanation.[13] En el @1980s, dirhodium los catalizadores han solido generar el carbenoid para cyclopropanation. El advenimiento de metallochemistry ha mejorado la selectividad de las proporciones de producto del cyclohexatriene derivados a través de elección de ligand en el carbenoid catalizador.[14]
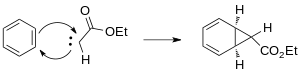

El segundo paso del Buchner la reacción implica un pericyclic expansión de anillo concertado. Basado en Woodward@–Hoffmann reglas, el electrocyclic abriendo de norcaradiene los derivados es un 6 -electrón disrotatory (π 4s + σ 2s), thermally dejó proceso.
El norcaradiene-cycloheptatriene el equilibrio ha sido estudiado extensamente.[15] La posición del equilibrio depende de steric, electrónico y conformational efectos. Debido a conformational tensión en el cyclopropane anillo del norcaradiene las mentiras de equilibrio en el lado del cycloheptatriene. El equilibrio puede ser cambiado hacia el norcaradiene por destabilization del cycloheptatriene por sustitución voluminosa (grande sterically obstaculizó grupos i. e. t-Butilo) en C1 y C6.
El equilibrio puede ser alterado por sustitución variable en C7. El electrón que da grupos (EDG) favorece el norcaradiene, mientras el electrón que retira grupos (EWG) favorece el cycloheptatriene.
El tautomerism del norcaradiene y cycloheptatriene puede ser entendió basado en el Walsh cyclopropane molecular orbitals del norcaradiene cyclopropane anillo. Racionalización electrónica para estabilización del Walsh orbitals es posible para ambos electrón que retira y el electrón que da grupos en el C7 carbono.[15] El molecular orbitals del electrón que retira grupos en C7 overlap con el HOMO Walsh orbitals del cyclopropane el anillo que causa un acortamiento del C1-C6 vínculo. En el caso del electrón que da grupos, orbitales overlap es otra vez posible ahora en el LUMO, resultando en un aumento en antibonding carácter destabilizing el norcaradiene tautomer. La posición del equilibrio puede ser controlada según el carbene substituents.
Aplicaciones
La importancia del Buchner expansión de anillo annulation la química es evidente en la aplicación de esta secuencia sintética en la síntesis de compuestos biológicos.
Mientras estudiando una reacción análoga de carbene adición a thiophene, Stephen Matlin y Lam Chan aplicó el Buchner método de expansión del anillo en 1981 para generar spiro derivados de Penicilina.[7]
En 1998, Mander et al. synthesized El diterpenoid tropone, Harringtonolide utilizando el Buchner intramolecular expansión de anillo annulation química.[6] Un rhodium catalizador (Rh2(mandelate)4) y DBU (1,8-diazabicyclo[5.4.0]undec-7-ene) solió generar el carbene. Este producto natural estuvo encontrado para tener antineoplastic y antiviral propiedades.
Danheiser Et al. Utilizado intramolecular carbenoid generación para producir sustituida azulenes a través de un Buchner expansión de anillo del tipo. El anti-fármaco de úlcera, Egualen (KT1-32) era synthesized utilizando esta expansión de anillo-annulation estrategia con un rhodium catalizador (Rh2(OCOt-Bu)4) en éter.[4][5]
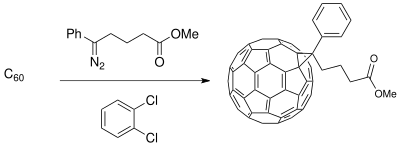
Ciencia material:
Las desventajas de la reacción implican reacciones de lado del carbene moiety. La elección de solvente para las necesidades de reacción para ser considerados. Además del potencial para carbono-reacciones de inserción de vínculo de hidrógeno, carbono-halogen carbene la inserción es posible cuándo dichloromethane está utilizado como el solvente.[16]


- Electrocyclic Reacción
- Cycloheptatriene
- Carbene
- ↑ Buchner, E.; Curtius, T. (1885), «Ueber die Einwirkung von Diazoessigather auf aromatisch Kohlenwasserstoffe», Ber. Dtsch. Chem. Ges. 18 (2): 2377-2379, doi:10.1002/cber.188501802119.
- ↑ Buchner, E.; Curtius, T. (1885), «Synthesis of beta-Keto esters from aldehydes and diazoacetic acid.», Ber. Dtsch. Chem. Ges. 18 (2): 2371-2377, doi:10.1002/cber.188501802118.
- ↑ Hubert, A. J.; Noels, A. F.; Anciaux, A. J.; Warin, R.; Teyssie, P. (1981), «Transition-Metal-CatalyzedReactions of Diazo Compounds. 2.' Addition to Aromatic Molecules: Catalysis of Buchner's Synthesis of Cycloheptatrienes», J. Org. Chem. 46 (5): 873-876, doi:10.1021/jo00318a010.
- ↑ a b Danheiser, R. L.; J. L. Kane, J.; Shea, K. M.; Crombie, A. L. (2001), «A Ring Expansion−Annulation Strategy for the Synthesis of Substituted Azulenes. Preparation and Suzuki Coupling Reactions of 1-Azulenyl Triflates», Org. Lett. 3 (7): 1081-1084, doi:10.1021/ol0156897.
- ↑ a b Danheiser, R. L.; Crombie, A. L.; Kane, J. L. J.; Shea, K. M. (2004), «Ring Expansion-Annulation Strategy for the Synthesis of Substituted Azulenes and Oligoazulenes. 2. Synthesis of Azulenyl Halides, Sulfonates, and Azulenylmetal Compounds and Their Application in Transition-Metal- Mediated Coupling Reactions», J. Org. Chem. 69 (25): 8652-8667, doi:10.1021/jo048698c.
- ↑ a b Mander, L. N.; Frey, B.; Wells, A. P.; Rogers, D. H. (1998), «Synthesis of the Unusual Diterpenoid Tropones Hainanolidol and Harringtonolide», J. Am. Chem. Soc. 120 (8): 1914-1915, doi:10.1021/ja9738081.
- ↑ a b Matlin, S. A.; Chan, L. (1981), «New spiro derivatives of penicillin», Tetrahedron Letters 22 (40): 4025-4028, doi:10.1016/S0040-4039(01)82055-4.
- ↑ Reisman, S. E.; Nani, R. R.; Levin, S. (2011), «Buchner and Beyond: Arene Cyclopropanation as Applied to Natural Product Total Synthesis», Synlett 7 (17): 2437-2442, doi:10.1055/s-0031-1289520.
- ↑ Prato, M. (1997), «[60]Fullerene chemistry for materials science applications», J. Mater. Chem. 7 (7): 1097-1109, doi:10.1039/A700080D.
- ↑ Wudl, F.; Gonzalez, R.; Hummelen, J. C. (1995), «The Specific Acid-Catalyzedand Photochemical Isomerization of a Robust Fulleroid to a Methanofullerene», J. Org. Chem. 60 (8): 2618-2620, doi:10.1021/jo00113a049.
- ↑ Wudl, F.; Hummelen, J. C.; Knight, B. W.; LePeq, F. (1995), «Preparation and Characterization of Fulleroid and Methanofullerene Derivatives», J. Org. Chem. 60 (3): 532-538, doi:10.1021/jo00108a012.
- ↑ Searle, N. E. (1956), «Ethyl Diazoacetate», Organic Syntheses 36: 25, doi:10.15227/orgsyn.036.0025.
- ↑ Lebel, H.; Marcoux, J.; Molinaro, C.; Charette, A. (2003), «Stereoselective Cyclopropanation Reactions», Chem. Rev. 103 (4): 977-1050, PMID 12683775, doi:10.1021/cr010007e.
- ↑ McKervey, A.; Ye, T. (1994), «Organic Synthesis with alpha-Diazocarbonyl Compounds», Chem. Rev. 94 (4): 1091-1160, doi:10.1021/cr00028a010.
- ↑ a b Maguire, A. R.; McNamara, O. A. (2011), «The norcaradieneecycloheptatriene equilibrium», Tetrahedron 67: 9-40, doi:10.1016/j.tet.2010.10.030.
- ↑ Lovely, C. J.; Browning, R. G.; Badarinaray, V.; Rasika Dias, H. V. (2005), «A silver-catalyzed Buchner reaction», Tetrahedron Letters 46 (14): 2453-2455, doi:10.1016/j.tetlet.2005.02.052.
