Diferencia entre revisiones de «Célula NK»
→Anatomía microscópica: Enlace |
→Funciones: Texto con referencia |
||
| Línea 33: | Línea 33: | ||
[[File:Cél NK sinapsis inmunes inhibidoras y activadoras.png|thumb |izq|240px|Sinapsis inmunitaria NK, pueden ser tanto activadoras(NK#2) como inhibidoras(NK#1) con las células blanco (221).]] |
[[File:Cél NK sinapsis inmunes inhibidoras y activadoras.png|thumb |izq|240px|Sinapsis inmunitaria NK, pueden ser tanto activadoras(NK#2) como inhibidoras(NK#1) con las células blanco (221).]] |
||
Las células asesinas tienen la capacidad de diferenciar las células infectadas por un [[virus]], o las células [[tumor]]ales que han sufrido transformaciones malignas. Son capaces de identificar qué células son propias del [[hospedador]] y cuales son foráneas. <br /> |
Las células asesinas tienen la capacidad de diferenciar las células infectadas por un [[virus]], o las células [[tumor]]ales que han sufrido transformaciones malignas. Son capaces de identificar qué células son propias del [[hospedador]] y cuales son foráneas. <br /> |
||
Esto pasa gracias a que los receptores de membrana de la célula asesina detectan la presencia de las [[moléculas de histocompatibilidad|MHC de clase 1]] en este tipo de células dañadas y receptores inhibidores en células sanas. Este sistema sencillo de reconocimiento de las células sanas y de las células dañadas es muy eficaz. |
Esto pasa gracias a que los receptores de membrana de la célula asesina detectan la presencia de las [[moléculas de histocompatibilidad|MHC de clase 1]] en este tipo de células dañadas y receptores inhibidores en células sanas. Este sistema sencillo de reconocimiento de las células sanas y de las células dañadas es muy eficaz. <br /> |
||
=== Receptores activadores === |
|||
Los receptores de activación de células NK se acumulan mediante un proceso dependiente de actina en las sinapsis inmunes citotóxicas, donde proporcionan señales sinérgicas que desencadenan las funciones efectoras de células NK. |
|||
=== Receptores inhibidores === |
|||
En contraste, los receptores inhibidores de las células NK, la familia de receptores MHC tipo I (KIR), se acumulan en las sinapsis inmunes inhibitorias, bloquean la dinámica de actina y evitan la fosforilación dependiente de actina de los receptores de activación.<ref>{{cita publicación |autores=Schleinitz N, March ME, Long EO. |título=Recruitment of Activation Receptors at Inhibitory NK Cell Immune Synapses|año=2008|publicación=PLoS ONE |volumen=3|número=9|página= e3278| |
|||
url=https://doi.org/10.1371/journal.pone.0003278}}</ref> |
|||
Además de este sistema liberan [[interferón]] y otras [[citocina]]s para desencadenar su respuesta inespecífica y destruir la célula que ha expulsado dicha sustancia, al verse atacada por una acción vírica. El reconocimiento de células diana induce a la movilización de gránulos hacia el sitio de contacto, los cuales contienen granzimas y perforinas. Estas proteínas forman un complejo, junto con una tercera proteína que actúa como carrier, el cual es endocitado por la bacteria. Esta endocitosis esta mediada por el receptor manosa 3-fosfato. |
|||
Las perforinas desestabilizan la membrana del endosoma, liberando a las granzimas, que inducen apoptosis celular |
Las perforinas desestabilizan la membrana del endosoma, liberando a las granzimas, que inducen apoptosis celular |
||
Revisión del 00:44 6 mar 2018
| Célula NK, Natural Killer | ||
|---|---|---|
 Célula Natural Killer. Microscopio de barrido. | ||
| Nombre y clasificación | ||
| Sinónimos |
| |
| Latín | Lymphocytus K | |
| TH | H2.00.04.1.02006 | |
| Información anatómica | ||
| Sistema | Inmune | |
|
| ||
Las células NK (siglas en inglés de Natural Killer, asesina natural o células asesinas son uno de los tipos de linfocitos del sistema inmunitario. También se las conoce como células nulas. Morfológicamente son prácticamente indistinguibles a los linfocitos grandes excepto por los gránulos que contienen.
Las células NK son componentes importantes del sistema inmune innato en la defensa del organismo. Su función está relacionada con la destrucción de células infectadas o bien cancerígenas. No son células fagocíticas, destruyen las células a través del ataque a su membrana plasmática causando la lisis.
Se cree que estas células detectan a la célula diana por reconocimiento del glicocálix anómalo. También se cree que las reconocen cuando las células infectadas o tumorales pierden la MHC de clase I, las cuales inhiben la acción de las células NK. Las células NK están químicamente caracterizadas por la presencia del marcador CD56 y ausencia de CD3.
Anatomía microscópica

Con el microscopio óptico se ven como linfocitos llenos de gránulos citoplasmáticos por lo que se conocían como células LGG (Linfocito Grande Granuloso).

Con el microscopio electrónico se caracterizan por sus gránulos y la estructura de los mismos. Los gránulos líticos que se encuentran en el citoplasma de la célula NK, son lisosomas secretores. Esto es: tienen características tanto del compartimento celular lisosómico, como de la maquinaria secretora especializada de la célula NK. El resultado es un orgánulo de doble función, una función especializada en actividades destructivas debido a sus propiedades lisosómicas y además una función secretora asociada.[1]
Fisiología
No expresan un receptor de membrana especial de los linfocitos, el TCR o receptor de linfocito T (la Ig de membrana típica de linfocitos B, CD3, etc.). Además, no madura en el timo, como lo hacen las células T. Tampoco expresan marcadores celulares fenotípicos que tradicionalmente identifican al resto de las subpoblaciones de linfocitos. En sus membranas sólo expresan CD2, CD16 y LFA-1, diferenciándolas de las células T que siempre son CD3+ y CD16-. Se localizan principalmente circulando en sangre y en el bazo, rara vez en otros tejidos.
Funciones
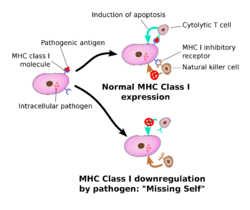

Las células asesinas tienen la capacidad de diferenciar las células infectadas por un virus, o las células tumorales que han sufrido transformaciones malignas. Son capaces de identificar qué células son propias del hospedador y cuales son foráneas.
Esto pasa gracias a que los receptores de membrana de la célula asesina detectan la presencia de las MHC de clase 1 en este tipo de células dañadas y receptores inhibidores en células sanas. Este sistema sencillo de reconocimiento de las células sanas y de las células dañadas es muy eficaz.
Receptores activadores
Los receptores de activación de células NK se acumulan mediante un proceso dependiente de actina en las sinapsis inmunes citotóxicas, donde proporcionan señales sinérgicas que desencadenan las funciones efectoras de células NK.
Receptores inhibidores
En contraste, los receptores inhibidores de las células NK, la familia de receptores MHC tipo I (KIR), se acumulan en las sinapsis inmunes inhibitorias, bloquean la dinámica de actina y evitan la fosforilación dependiente de actina de los receptores de activación.[2]
Además de este sistema liberan interferón y otras citocinas para desencadenar su respuesta inespecífica y destruir la célula que ha expulsado dicha sustancia, al verse atacada por una acción vírica. El reconocimiento de células diana induce a la movilización de gránulos hacia el sitio de contacto, los cuales contienen granzimas y perforinas. Estas proteínas forman un complejo, junto con una tercera proteína que actúa como carrier, el cual es endocitado por la bacteria. Esta endocitosis esta mediada por el receptor manosa 3-fosfato. Las perforinas desestabilizan la membrana del endosoma, liberando a las granzimas, que inducen apoptosis celular
Debido a su capacidad de destrucción de células, se está estudiando usarlas como tratamiento contra el cáncer.
Activación

Las células NK se activan por interferones, los cuales son producidos por las células infectadas por virus (es un proceso feed-back). También se activan por otras citocinas: las interleucinas-2, las cuales se forman en los linfocitos T activados. [3]
Una vez que el sistema inmunitario específico se ha activado, los anticuerpos tienen un papel de activación de las células NK, pues éstas también tienen función citotóxica (tóxicas para la célula). Las células NK poseen receptores específicos para la región Fc de la inmunoglobulina G (FcγRIII). Cuando una célula está infectada por virus, los antígenos de éstos, se presentan en la superficie de la célula infectada y los anticuerpos unidos a la NK, a su vez se unen a la célula infectada.
A las células NK activadas por interleucinas-2 en laboratorio, se las denomina células LAK.
Referencias
- ↑ Orange, JS (2008). «Formation and function of the lytic NK-cell immunological synapse». Nat Rev Immunol. 8 (9): 713-725. Consultado el 5 de marzo de 2018.
- ↑ Schleinitz N, March ME, Long EO. (2008). «Recruitment of Activation Receptors at Inhibitory NK Cell Immune Synapses». PLoS ONE 3 (9): e3278.
- ↑ Xu Y, Zhou S, Lam YW, Pang S W (2017). «Dynamics of Natural Killer Cells Cytotoxicity in Microwell Arrays with Connecting Channels». Front. Immunol. Consultado el 5 de marzo de 2018.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Célula NK.
Wikimedia Commons alberga una categoría multimedia sobre Célula NK.
