Oxoanión
Un oxoanión es una especie química cuya fórmula genérica es AxOyz− (donde A representa un elemento químico, generalmente un no-metal, y O representa un átomo de oxígeno). Los oxoaniones se forman con una gran diversidad de elementos químicos.[1] Las fórmulas de los oxoaniones simples se determinan por la regla del octeto. Las estructuras de los oxoaniones condensados se pueden considerar en términos de unidades poliédricas AOn que comparten los vértices o las aristas entre dichos poliedros. Los ésteres de monofosfato (AMP) y de polifosfato (ADP y ATP) son importantes en biología.
El elemento central del oxoanión puede ser un átomo de no-metal (excluido el hidrógeno), un átomo de semimetal o, incluso, un átomo de metal del grupo 5 (V, Nb, Ta), del grupo 6 (Cr, Mo, W) o del grupo 7 (Mn, Tc, Re) de la tabla periódica.[2]
Oxoaniones simples o monómeros[editar]
La fórmula de los oxoaniones monómeros son del tipo AOnm−, dependiendo del estado de oxidación del elemento A y de su posición en la tabla periódica. Los elementos de la primera fila o segundo período de la tabla periódica (B, C, N) están limitados a un número de coordinación máximo de 4. Sin embargo, ninguno de los elementos de la primera fila tiene un anión monómerico con ese número de coordinación. Por ejemplo, los iones carbonato (CO32−) y nitrato (NO3−) tienen una estructura trigonal plana con enlace π (pi) entre el átomo central y los átomos de oxígeno. Este enlace π está favorecido por la similitud en tamaño del átomo central y del oxígeno.
Los oxoaniones de elementos del tercer periodo (Al, Si, P, S y Cl) con el estado de oxidación principal del grupo, son tetraédricos. Por ejemplo, unidades tetraédricas SiO44- se encuentran en el mineral olivino, un ortosilicato de magnesio y hierro, [Mg, Fe]SiO4, pero el anión no tiene una existencia por separado pues los átomos de oxígeno están rodeados tetraédricamente por cationes en el estado sólido. Los aniones fosfato (PO43−), sulfato (SO42−), y perclorato (ClO4−) pueden encontrarse como tales en varias sales. Muchos oxoaniones de elementos con estados de oxidación más bajos cumplen la regla del octeto y esto se puede usar para racionalizar las fórmulas adoptadas. Por ejemplo, el cloro (V) tiene dos electrones de valencia por lo que puede acomodar tres pares de electrones de los enlacescon los iones óxido. La carga del ion es +5 −3×2 = −1, y por ello la fórmula es ClO3−. La estructura del ion se predice por la teoría RPECV como de forma piramidal, con tres pares de electrones enlazantes y un par no compartido. De forma similar, el oxoanión de cloro (III) tiene la fórmula ClO2−, y es angular con dos pares de electrones enlazantes y otros dos pares no compartidos.
| Estado de oxidación | Nombre | Fórmula | Imagen | Geometría del ion |
|---|---|---|---|---|
| +1 | Ion hipoclorito | ClO− | 
|
Lineal |
| +3 | Ion clorito | ClO2− | 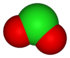
|
Angular |
| +5 | Ion clorato | ClO3− | 
|
Pirámide trigonal |
| +7 | Ion perclorato | ClO4− | 
|
Tetraédrica |
En los siguientes periodos de la tabla periódica, 5º y 6º, es posible el índice de coordinación 6, pero los oxoaniones aislados con forma octaédrica no se conocen debido a que deberían tener una carga eléctrica demasiado alta. Por ello, el molibdeno (VI) no forma el ion MoO66−, sino que forma el anión molibdato tetraédrico, MoO42−. Unidades de MoO66− se han encontrado en los molibdatos condensados. Es posible encontrar oxoaniones completamente protonados y con estructura octaédrica como Sn(OH)62− y Sb(OH)6−.
Oxoaniones más frecuentes[editar]
- Con grupos óxido terminales:
- Con grupos óxido terminales y grupos óxido de conexión entre dos átomos de no-metal:
- dicromato
- pirofosfato
- polioxometalatos tales como fosfomolibdatos y fosfowolframatos.
Se describen con más detalle en el apartado siguiente.
Método para determinar el número de oxígenos en un oxoanión, su carga y la valencia del elemento central[editar]
Al estudiar Química Inorgánica, sea en el nivel medio o en el nivel terciario, suele pedírsele al estudiante que elabore la fórmula molecular de un compuesto binario, ternario o cuaternario a partir del nombre de dicho compuesto. En el caso de los oxoácidos, oxosales e hidrogenoxosales, la nomenclatura está directamente relacionada al oxoanión presente en estos compuestos. Sabiendo que la nomenclatura de los oxoaniones se construye de la siguiente manera:
- Si el elemento central (es decir, el que se enlaza a los átomos de oxígeno) presenta solo un estado de oxidación al formar oxoaniones (más abajo se explica cómo determinar esto), la terminación será siempre -ato. Ejemplo: carbonato, borato.
- Si el elemento central presenta dos estados de oxidación posibles al formar oxoaniones, la terminación será -ito para el estado de oxidación menor y -ato para el mayor. Ejemplos: nitrito y nitrato (ambos son oxoaniones del nitrógeno).
- Si el elemento central tiene tres o más estados de oxidación (E.O a partir de ahora) posibles al formar oxoaniones, el nombre se construye de la siguiente manera:
- Si usa el E.O menor, la nomenclatura del oxoanión será de la forma: "hipo"+"elemento central"+"ito". Ejemplos: hipoclorito, hipobromito.
- Si usa el segundo E.O, la nomenclatura del oxoanión será de la forma: "elemento central"+"ito". Ejemplos: clorito, bromito.
- Si usa el tercer E.O, la nomenclatura del oxoanión será de la forma: "elemento central"+"ato". Ejemplos: bromato, iodato, clorato.
- Si usa el cuarto E.O, la nomenclatura del oxoanión será de la forma: "per"+"elemento central"+"ato". Ejemplos: perclorato, perbromato.
El paso siguiente consiste en determinar cuántos E.O usa un determinado elemento químico al formar oxoaniones.
- Primero hay que saber (y recordar, o mirar en la Tabla periódica) que el oxígeno al formar oxoaniones siempre usa el E.O: -2.
- Segundo: la carga del oxoanión (que por ser un anión es negativa) siempre, salvo en el manganeso (ver nota al final de este párrafo), será el primer estado de oxidación del elemento químico central pero expresado como número negativo. Es decir, en el carbono, por ejemplo, el primer E.O es +2, por lo tanto, al formar un oxoanión, este tendrá carga: -2. Otros ejemplos: El boro solo tiene un estado de oxidación: +3, por lo tanto, al formar un oxoanión (como el borato), este tendrá carga: -3. El bromo tiene cuatro estados de oxidación posibles al formar oxoaniones: +1,+3,+5 y +7, pero en todos y cada uno de ellos, la carga será: -1, que es el primer E.O del bromo, expresado como número negativo.
Nota: el manganeso forma oxoaniones con carga -1 (ejemplo: el permanganato), a pesar de que su primer estado de oxidación es +2.
Ahora bien, para determinar cuántos E.O puede usar un elemento químico al formar oxoaniones, y teniendo en cuenta lo expresado más arriba, puede usarse el siguiente procedimiento:
- Mirar la Tabla periódica para determinar la carga que tendrá el oxoanión, independientemente del estado de oxidación que use el elemento central (como se explica más arriba).
- Tomar un valor de E.O del elemento central y empezar a "añadirle" átomos de oxígeno (que como ya se vio, siempre tienen valencia -2 en el caso de los oxoaniones). Si por ejemplo el elemento central es el azufre, su primer E.O es +2. Si le añadimos un átomo de oxígeno, la carga del oxoanión quedará en cero, por lo cual sabremos que +2 no es E.O del azufre al formar oxoaniones.
Si tomamos el siguiente valor de E.O del azufre, que es +4, y le añadimos 1 oxígeno, su carga será de +2 (tampoco es válido, pues los aniones siempre tienen carga negativa). Si le añadimos otro oxígeno, la carga quedará nuevamente en cero (+4 del azufre y 2.(-2) de los dos oxígenos: 4-4 = 0). Siguiendo este procedimiento, le añadimos otro oxígeno: 3.(-2) = -6 +4 = -2, por lo que ya sabemos que +4 es uno de los E.O del azufre al formar oxoaniones. Siguiendo con este método, podemos evaluar el siguiente E.O del azufre en la tabla periódica, que es +6. Sabiendo que cada oxígeno tiene valencia -2 y que los oxoaniones del azufre tienen siempre carga -2 (como se explicó anteriormente), si estamos usando el E.O +6 podemos determinar que la cantidad de oxígenos que se enlazarán al azufre será cuatro, pues 4.(-2) = -8, y -8 +6 = -2..
Si necesitamos determinar por ejemplo la fórmula del ácido sulfúrico, y sabemos que la terminación -ico en un oxoácido corresponde a la terminación -ato del oxoanión por el cual está formado (además del o los hidrógenos), (y que la terminación -oso corresponde a -ito), podremos determinar que el oxoanión en este caso es el sulfato. Recordando el procedimiento explicado más arriba, sabremos qué estado de oxidación está usando el azufre, qué carga tienen sus oxoaniones, y por ende, cuántos oxígenos se le deben añadir para alcanzar dicha carga. En este caso, el oxoanión sulfato presenta la fórmula: SO42-. Como estamos intentando determinar la fórmula del ácido sulfúrico, debemos añadirle hidrógeno a la fórmula del sulfato. Para determinar cuántos hidrógenos se deben añadir, debemos recordar que el hidrógeno en un ácido siempre tiene E.O +1. En este caso, se deben añadir 2 hidrógenos para que la suma de los estados de oxidación del compuesto sea cero: +1.2 = 2. Como el oxoanión sulfato tiene carga -2, la carga total queda en cero. (-2 + 2). De este modo llegamos a la fórmula del oxoácido ácido sulfúrico: H2SO4.
Oxoaniones condensados[editar]
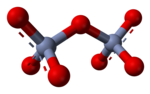
En disolución acuosa, los oxoaniones con carga grande pueden sufrir reacciones de condensación, como la formación del ion dicromato, Cr2O72−:
- 2 CrO42− + 2 H+
 Cr2O72− + H2O
Cr2O72− + H2O
La fuerza que da lugar a esta reacción es la reducción de la densidad de carga eléctrica sobre el anión y la eliminación de los iones hidrógeno. La cantidad de orden en la disolución disminuye, liberando una cierta cantidad de entropía lo que hace más negativa la energía libre de Gibbs y favorece la reacción directa. Es un ejemplo de una reacción ácido-base con el oxoanión monomérico actuando como base y el oxoanión condensado actuando como ácido conjugado. La reacción inversa es una reacción de hidrólisis, en la que una molécula de agua, actuando como base, se divide. Pueden ocurrir condensaciones adicionales, particularmente con aniones de carga elevada, como ocurre con los fosfatos de adenosina.
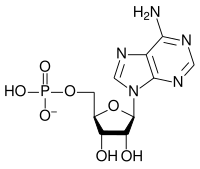
|

|
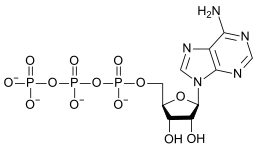
|
| AMP | ADP | ATP |

La conversión de ATP en ADP es una reacción de hidrólisis y es una importante fuente de energía en los sistemas biológicos.
La formación de la mayoría de los silicatos minerales pueden ser vistos como resultado de una reacción de des-condensación en la que la sílice reacciona con un óxido básico, una reacción ácido-base en el sentido de Lux-Flood.
- CaO (base) + SiO2 (ácido) → CaSiO3
Estructuras y fórmulas de los polioxianiones[editar]

Un polioxianión es un oxoanión polimérico en el cual múltiples oxoaniones monómeros, habitualmente vistos como poliedros de MOn, se unen compartiendo vértices o aristas.[3] Cuando se comparten dos vértices de un mismo tetraedro, la estructura resultante puede ser una cadena o un anillo. Cadenas cortas se dan, por ejemplo, en los polifosfatos. Los inosilicatos, como los piroxenos, tienen una larga cadena de tetraedros de SiO4 cada uno de los cuales compartedos vértices. la misma estructura se da en los llamados meta-vanadatos, como el metavanadato de amonio, NH4VO3.
La fórmula del oxoanión, SiO32− se obtiene de la siguiente manera: cada ion silicio nominal (Si4+) es atacado por dos iones óxido nominales (O2−) y tiene una mitad compartido con otros dos. Por tanto la estequiometría y la carga vienen dadas por:
- Estequiometría: Si + 2 O +2×½ O = SiO32−
- Carga: +4 + (2 × − 2) + (2 × (½ × −2)) = −2.
Un anillo se puede ver como una cadena en la que los dos extremos se han unido. Los ácidos fosfóricos y los fosfatos cíclicos (trifosfato cíclico), P3O93−, son un ejemplo.
Cuando se comparten tres vértices, la estructura se extiende en dos dimensiones. En los anfíboles, (por ejemplo, en los asbestos) dos cadenas se enlazan juntas compartiendo un tercer vértice en lugares alternados a lo largo de la cadena. Esto da como resultado una fórmula ideal [Si4O11]6− y una estructura de cadena lineal que explica la naturaleza fibrosa de estos minerales. La compartición de los tres vértices puede dar como resultado una estructura laminar, como en la mica, [Si2O5]2−, en la cual cada átomo de silicio tiene un oxígeno en exclusiva para sí mismo y una mitad compartida en los otros tres. La mica cristalina puede ser partida en láminas muy finas.
La compartición de los cuatro vértices de los tetraedros da como resultado una estructura tridimensional, como en el cuarzo. Los aluminosilicatos son minerales en los que algunos átomos de silicio son reemplazados por átomos de aluminio. Sin embargo, el estado de oxidación del aluminio es una unidad inferior que el del silicio, por lo que la recolocación debe acompañarse con la adición de otro catión. El número de posibles combinaciones de tal estructura es muy grande, lo que es, en parte, la razón por la que hay tantos aluminosilicatos.
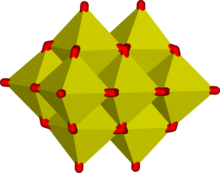
Las unidades octaédricas del tipo MO6 son habituales en oxoaniones de los metales de transición más grandes. Algunos compuestos, como las sales del ion de cadena polimérica, Mo2O72− contienen incluso ambos tipos de unidades tetraédricas y octaédricas.[4][5] La compartición de aristas es frecuente en iones que contienen bloques de construcción octaédricos y los octaedros se distorsionan habitualmente para reducir la tensión en losátomos de oxígeno que actúan como puente. Como resultado de esto, se forman estructuras tridimensionales llamadas polioxometalatos. Ejemplos típicos se dan en la estructura de Keggin del ion fosfomolibdato. La compartición de aristas es un medio eficaz de reducir la densidad de carga eléctrica, como se puede ver en la reacción de condensación hipotética en la que intervinieran dos octaedros:
- 2 MO6n− + 4 H+ → M2O10(n−4)− + 2 H2O
Aquí, la carga media sobre cada átomo M se reduce a 2.la eficacia de la compartición de aristas se demuestra mediante la siguiente reacción, que tiene lugar cuando se acidifica una solución acuosa alcalina de molibdato.
- 7 MoO42− + 8 H+
 Mo7O246− + 4 H2O
Mo7O246− + 4 H2O
El ion molibdato tetraédrico se convierte en un agregado o clúster de 7 octaedros enlazados por las aristas,[5][6] resultando una carga media sobre cada átomo de molibdeno de 6/7. El clúster heptamolibdato es tan estable que no han sido detectados los agregados con un número de unidades de molibdato comprendido entre 2 y 6 incluso aunque deben formarse como intermedios de la reacción.
Propiedades ácido-base[editar]
La mayoría de los oxoaniones son bases débiles y pueden ser protonados para dar ácidos o sales ácidas. Por ejemplo, el ion fosfato puede ser protonado sucesivamente hasta formar ácido fosfórico.
- PO43− + 3 H+
 HPO42− + 2 H+
HPO42− + 2 H+  H2PO4− + H+
H2PO4− + H+  H3PO4
H3PO4


La extensión de la protonación en disolución acuosa dependerá de la constante de acidez y del pH. Por ejemplo, la adenosinmonofosfato (AMP) tiene un valor de pKa de 6.21,[7] Por ejemplo, para un pH=7 estará protonada en torno al 10%. La neutralización de la carga es un factor importante en estas reacciones de protonación. Por el contrario, los aniones univalentes perclorato y permanganato son muy difíciles de protonar, por lo que sus ácidos correspondientes son ácidos fuertes.
Aunque ácidos como el ácido fosfórico se escriben como H3PO4, los protones están enlazados al átomo de oxígeno formando grupos hidroxilo, por lo que la fórmula también se puede escribir según las normas de la IUPAC como OP(OH)3 para reflejar mejor la estructura molecular. De igual modo, la fórmula del ácido sulfúrico se puede escribir como O2S(OH)2; así es como se observa la molécula en fase gaseosa, cuando no está disociada.
El ion fosfito, PO33−, es una base fuerte, y por ello siempre lleva al menos un protón. En este caso, el protón se enlaza directamente al átomo de fósforo con la estructura HPO32−. Al formarse este ion, el ion fosfito se comporta como una base de Lewis y dona un par de electrones al ácido de Lewis, H+.

Como se ha mencionado anteriormente, una reacción de condensación es también una reacción ácido-base. En muchos sistemas, pueden ocurrir a la vez las reacciones de protonación y de condensación. El caso del ion cromato proporciona un ejemplo relativamente sencillo. En el diagrama de predominancia para el cromato, que se muestra a la derecha, pCr representa el menos logaritmo de la concentración de cromo y pH representa el menos logaritmo de la concentración de ion hidrógeno. Hay dos equilibrios independientes. Las constantes de equilibrio se definen como se indica a continuación.[8]
CrO42− + H+  HCrO4−
HCrO4−
log K1=5.89 2 HCrO4−  Cr2O72− + H2O
Cr2O72− + H2O
log K2=2.05
Eldiagrama de predominancia se interpreta del siguiente modo.
- El ion cromato, CrO42−, es la especie predominante para pH elevado. Según aumenta el pH elión cromato se hace cada vez más predominante, hasta ser la única especie en disolución para pH > 6,75
- Para pH < pK1, el ion hidrogenocromato, HCrO4− es predominante en disoluciones diluidas.
- El ion dicromato, Cr2O72−, es predominante en disoluciones más concentradas, excepto para pH elevado.
Las especies H2CrO4 y HCr2O7− no semuestran en el diagrama porque sólo seforman para valores muy bajos del pH.
Los diagramas de predominancia pueden ser muy complicados cuando pueden formarse muchas especies polímeras,[9] como ocurre en los vanadatos, molibdatos, y wolframatos. Otra complicación es que muchos de los polímeros de mayor orden se forman con extremada lentitud, por lo que tales equilibrios pueden tardar hasta meses en alcanzarse, lo que conduce a posibles errores en los valores de las constantes de equilibrio y los diagramas de predominancia.
Referencias[editar]
- ↑ Greenwood & Earnshaw.
- ↑ http://books.google.es/books?id=6h32OtElkAsC&pg=PA383 Química. Enrique Gutiérrez Ríos. Editorial Reverté, 1985. ISBN 8429172165 Pág. 383
- ↑ Mueller, U. (1993). Inorganic Structural Chemistry. Wiley. ISBN 0471937177.
- ↑ Lindqvist, I. (1950). «Crystal Structure Studies on Anhydrous Sodium Molybdates and Tungstates». Acta Chem. Scand. 4: 1066-1074. doi:10.3891/acta.chem.scand.04-1066.
- ↑ a b Wells, A.F. (1962). Structural Inorganic Chemistry (3ª edición). Oxford: Clarendon Press. pág. 446
- ↑ Lindqvist, I. (1950). Arkiv Kemi 2: 325.
- ↑ da Costa, C.P.; Sigel, H. (2000). «Lead(II)-Binding Properties of the 5‘-Monophosphates of Adenosine (AMP2-), Inosine (IMP2-), and Guanosine (GMP2-) in Aqueous Solution. Evidence for Nucleobase−Lead(II) Interactions». Inorg. Chem. 39 (26): 5985-5993. doi:10.1021/ic0007207.
- ↑ Brito, F.; Ascanioa, J.; Mateoa, S.; Hernándeza, C.; Araujoa, L.; Gili, P.; Martín-Zarzab, P.; Domínguez, S. et al. (1997). «Equilibria of chromate(VI) species in acid medium and ab initio studies of these species». Polyhedron 16 (21): 3835-3846. doi:10.1016/S0277-5387(97)00128-9.
- ↑ Pope, M.T. (1983). Heteropoly and Isopoly Oxometalates. Springer. ISBN 0387118896.

![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2+}} ][\mathrm {H^{+}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba5183a196a004435f83e9cce025b6260ee6b4ed)
![{\displaystyle K_{2}={\frac {[\mathrm {Cr_{2}O_{7}^{2-}} ]}{[\mathrm {HCrO_{4}^{-}} ]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)