Ion oxonio
En química, un ion oxonio es cualquier catión de oxígeno con tres enlaces.[1] El ion oxonio más simple es el ion hidronio H3O+.[2]
Alquiloxonio
[editar]El hidronio es uno de una serie de iones de oxonio con la fórmula R3− nHnO+. El oxígeno suele ser piramidal con una hibridación sp3. Aquellos con n = 2 se denominan iones de oxonio primarios, un ejemplo es el metanol protonado. Otros iones de hidrocarburo oxonio se forman por protonación o alquilación de alcoholes o éteres (R−C−O−R1R2). En medios ácidos, el grupo funcional oxonio producido al protonar un alcohol puede ser un grupo saliente en la reacción de eliminación de E2. El producto es un alqueno. Generalmente se requieren condiciones extremas de acidez, calor y deshidratación.
Los iones de oxonio secundarios tienen la fórmula R2OH+, siendo un ejemplo los éteres protonados.
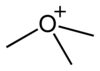
Los iones terciarios de oxonio tienen la fórmula R3O+, siendo un ejemplo el trimetiloxonio.[3] Las sales de alquiloxonio terciario son agentes alquilantes útiles. Por ejemplo, tetrafluoroborato de trietiloxonio (Et
3O+
)(BF−
4), un sólido cristalino blanco, se puede utilizar, por ejemplo, para producir ésteres etílicos cuando las condiciones de esterificación tradicional de Fischer no son adecuadas.[4] También se utiliza para la preparación de éteres enólicos y grupos funcionales relacionados.[5][6]
 |
 |
 |
 |
del ion oxonio |
catión trimetiloxonio |
de trimetiloxonio |
de trimetiloxonio |
El oxatriquinano y el oxatriquinaceno son iones de oxonio inusualmente estables, descritos por primera vez en 2008. El oxatriquinano no reacciona con agua hirviendo o con alcoholes, tioles, iones haluro o aminas, aunque sí reacciona con nucleófilos más fuertes como hidróxido, cianuro y azida.
Iones de oxocarbenio
[editar]Otra clase de iones de oxonio que se encuentran en la química orgánica son los iones de oxocarbenio, obtenidos por protonación o alquilación de un grupo carbonilo, por ejemplo, R−C=O−R′ que forma una estructura de resonancia con el carbocatión completo R−C−O−R′ y, por lo tanto, es especialmente estable:

Especies estabilizadas con oro
[editar]
Una especie de oxonio inusualmente estable es el complejo de oro tris [trifenilfosfina de oro (I)] tetrafluoroborato de oxonio, [(Ph3PAu)3O] [BF4], donde se cree que las interacciones aurofílicas intramoleculares entre los átomos de oro son responsables de la estabilización de los cationes.[7][8] Este complejo se prepara mediante el tratamiento de Ph3PAuCl con Ag2O en presencia de NaBF4:[9]
- 3 Ph3PAuCl + Ag2O + NaBF4 → [(Ph3PAu)3O]+[BF4]– + 2 AgCl + NaCl
Se ha utilizado como catalizador para la transposición de Claisen.[10]
Relevancia para la química de los productos naturales
[editar]Los iones oxonio complejos bicíclicos y tricíclicos han sido propuestos como intermediarios clave en la biosíntesis de una serie de productos naturales por las algas rojas del género Laurencia.[11]

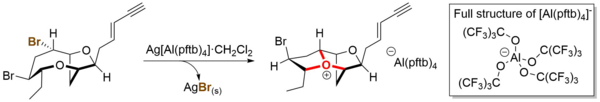
Varios miembros de estas elusivas especies han sido preparados explícitamente por síntesis total, demostrando la posibilidad de su existencia.[11] La clave para su generación exitosa fue el uso de un anión de coordinación débil (anión de Krossing, [Al (pftb)4]-, pftb = perfluoro-terc-butoxi) como contraanión.[12] Como se muestra en el siguiente ejemplo, esto se ejecutó mediante una estrategia de abstracción de haluro transanular mediante la reacción del precursor del ion oxonio (un haluro orgánico) con la sal de plata del anión de Krossing Ag[Al(pftb)4] • CH2Cl2, generando el ion oxonio deseado con precipitación simultánea de haluros de plata inorgánicos. Los iones de oxonio resultantes se caracterizaron exhaustivamente mediante espectroscopia de resonancia magnética nuclear a baja temperatura (–78 °C) con el apoyo del cálculo de la teoría funcional de la densidad.
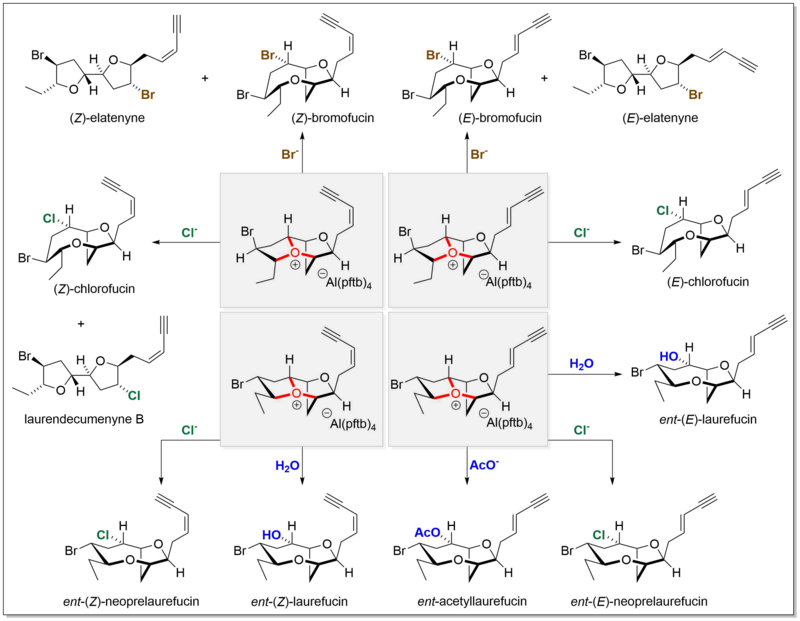
También se demostró que estos iones de oxonio dan lugar directamente a múltiples productos naturales relacionados al reaccionar con varios nucleófilos, como agua, bromuro, cloruro y acetato.[13][14][15]
Véase también
[editar]- Ion onio, un catión +1 derivado de la protonación de un hidruro (incluye iones de oxonio)
- Pirilio, uno de los iones de oxonio
Referencias
[editar]- ↑ March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (4th edición), New York: Wiley, p. 497.
- ↑ Olah, George A. (1998). Onium Ions. John Wiley & Sons. p. 509. ISBN 9780471148777.
- ↑ Olah, George A. (1993). «Superelectrophiles». Angew. Chem. Int. Ed. Engl. 32 (6): 767-88. doi:10.1002/anie.199307673.
- ↑ Raber, Douglas J.; Gariano Jr, Patrick; Brod, Albert O.; Gariano, Anne L.; Guida, Wayne C. (1977). «Esterification Of Carboxylic Acids With Trialkyloxonium Salts: Ethyl And Methyl 4-acetoxybenzoates». Org. Synth. 56: 59. doi:10.15227/orgsyn.056.0059.
- ↑ Struble, Justin R.; Bode, Jeffrey W. (2010). «Synthesis Of A N-mesityl Substituted Aminoindanol-derived Triazolium Salt». Org. Synth. 87: 362. doi:10.15227/orgsyn.087.0362.
- ↑ Hegedus, Lous S.; Mcguire, Michael A.; Schultze, Lisa M. (1987). «1,3-Dimethyl-3-methoxy-4-phenylazetidinone». Org. Synth. 65: 140. doi:10.15227/orgsyn.065.0140.
- ↑ Schmidbaur, Hubert (2000). «The Aurophilicity Phenomenon: A Decade of Experimental Findings, Theoretical Concepts and Emerging Application». Gold Bulletin 33 (1): 3-10. doi:10.1007/BF03215477.
- ↑ Schmidbaur, Hubert (1995). «Ludwig Mond Lecture: High-Carat Gold Compounds». Chem. Soc. Rev. 24 (6): 391-400. doi:10.1039/CS9952400391.
- ↑ Bruce, M. I.; Nicholson, B. K.; Bin Shawkataly, O.; Shapley, J. R.; Henly, T. (1989). «Synthesis of Gold-Containing Mixed-Metal Cluster Complexes». En Kaesz, Herbert D., ed. Inorganic Syntheses 26. John Wiley & Sons, Inc. pp. 324-328. ISBN 9780470132579. doi:10.1002/9780470132579.ch59.
- ↑ Sherry, Benjamin D.; Toste, F. Dean (2004). «Gold(I)-Catalyzed Propargyl Claisen Rearrangement». Journal of the American Chemical Society 126 (49): 15978-15979. ISSN 0002-7863. PMID 15584728. doi:10.1021/ja044602k.
- ↑ a b Sam Chan, Hau Sun; Nguyen, Q. Nhu N.; Paton, Robert S.; Burton, Jonathan W. (9 de octubre de 2019). «Synthesis, Characterization, and Reactivity of Complex Tricyclic Oxonium Ions, Proposed Intermediates in Natural Product Biosynthesis». Journal of the American Chemical Society 141 (40): 15951-15962. ISSN 1520-5126. PMID 31560524. doi:10.1021/jacs.9b07438.
- ↑ Krossing, Ingo (2001). «The Facile Preparation of Weakly Coordinating Anions: Structure and Characterisation of Silverpolyfluoroalkoxyaluminates AgAl(ORF)4, Calculation of the Alkoxide Ion Affinity». Chemistry – A European Journal 7 (2): 490-502. ISSN 1521-3765. PMID 11271536. doi:10.1002/1521-3765(20010119)7:2<490::aid-chem490>3.0.co;2-i.
- ↑ Wang, Bin-Gui; Gloer, James B.; Ji, Nai-Yun; Zhao, Jian-Chun (March 2013). «Halogenated Organic Molecules of Rhodomelaceae Origin: Chemistry and Biology». Chemical Reviews 113 (5): 3632-3685. ISSN 0009-2665. PMID 23448097. doi:10.1021/cr9002215.
- ↑ Zhou, Zhen-Fang; Menna, Marialuisa; Cai, You-Sheng; Guo, Yue-Wei (11 de febrero de 2015). «Polyacetylenes of Marine Origin: Chemistry and Bioactivity». Chemical Reviews 115 (3): 1543-1596. ISSN 0009-2665. PMID 25525670. doi:10.1021/cr4006507.
- ↑ Wanke, Tauana; Philippus, Ana Cláudia; Zatelli, Gabriele Andressa; Vieira, Lucas Felipe Oliveira; Lhullier, Cintia; Falkenberg, Miriam (1 de noviembre de 2015). «C15 acetogenins from the Laurencia complex: 50 years of research – an overview». Revista Brasileira de Farmacognosia 25 (6): 569-587. ISSN 0102-695X. doi:10.1016/j.bjp.2015.07.027.
