Diferencia entre revisiones de «Enlace metálico»
Sin resumen de edición |
m Revertidos los cambios de 190.25.175.224 a la última edición de 89.130.48.75 |
||
| Línea 1: | Línea 1: | ||
[[Archivo:Metallic bond Cu.svg|thumb|Enlace metálico en el [[Cobre]].]] |
|||
Un '''enlace metálico''' es un enlace químico que mantiene unidos los [[átomo]]s (unión entre [[cationes]] y los electrones de valencia) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de [[empaquetamiento compacto de esferas]]. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja [[electronegatividad]] que poseen los metales, los electrones de valencia son extraídos de sus orbitales y tienen la capacidad de moverse libremente a través del compuesto metálico, lo que otorga a éste las propiedades eléctricas y térmicas. |
Un '''enlace metálico''' es un enlace químico que mantiene unidos los [[átomo]]s (unión entre [[cationes]] y los electrones de valencia) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de [[empaquetamiento compacto de esferas]]. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja [[electronegatividad]] que poseen los metales, los electrones de valencia son extraídos de sus orbitales y tienen la capacidad de moverse libremente a través del compuesto metálico, lo que otorga a éste las propiedades eléctricas y térmicas. |
||
== Características de los metales == |
== Características de los metales == |
||
Revisión del 21:31 29 mar 2010
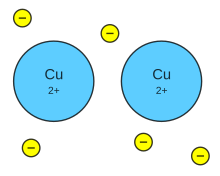
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre cationes y los electrones de valencia) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales y tienen la capacidad de moverse libremente a través del compuesto metálico, lo que otorga a éste las propiedades eléctricas y térmicas.
Características de los metales
Las características básicas de los elementos metálicos son producidas por la naturaleza del enlace metálico. Entre ellas destacan:
- Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente.
- Las conductividades térmicas y eléctricas son muy elevadas (esto se explica por la enorme movilidad de sus electrones de valencia menor).
- Presentan brillo metálico, por lo que son menos electronegativos.
- Son dúctiles y maleables (la enorme movilidad de los electrones de valencia hace que los cationes metálicos puedan moverse sin producir una situación distinta, es decir, una rotura).
- Pueden emitir electrones cuando reciben energía en forma de calor.
- Tienden a perder electrones de sus últimas capas cuando reciben cuantos de luz (fotones), fenómeno conocido como efecto fotoeléctrico.
El enlace metálico es característico de los elementos metálicos, es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Los átomos, al estar tan cercanos uno de otro, interaccionan los núcleos junto con sus nubes electrónicas empaquetándose en las tres dimensiones, por lo que quedan rodeados de tales nubes. Estos electrones libres son los responsables que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Presentan brillo y son maleables.
Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Los metales tienen puntos de fusión más altos por lo que se deduce que hay enlaces más fuertes entre los distintos átomos.
La vinculación metálica es no polar, apenas hay (para los metales elementales puros) o muy poca (para las aleaciones) diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación, y los electrones implicados en lo que es la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como fuerza, maleabilidad, ductilidad, conducción del calor y de la electricidad, y lustre. La vinculación metálica es la atracción electrostática entre los átomos del metal o los iones y electrones deslocalizados. Esta es la razón por la cual se explica un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes.
