Reacción de Favorskii
La reacción de Favorskii es una reacción química orgánica entre un alquino y un grupo carbonilo, en condiciones básicas. La reacción fue descubierta a principios del siglo XX por el químico ruso Alexei Yevgrafovich Favorskii..[1]

Cuando el carbonilo es un aldehído (R" = H), se produce una transposición que conduce a un enona. Cuando esta transposición es catalizada por un ácido, se denomina transposición de Meyer-Schuster.
Mecanismo de reacción y alcance[editar]
Un acetiluro metálico se forma in situ cuando un alquino se trata con bases fuertes como un hidróxido o un alcóxido:[2]
- HC≡CH + KOH
 HC≡CK + H2O
HC≡CK + H2O - RR'C=O + HC≡CK
 RR'C(VALE)C≡CH
RR'C(VALE)C≡CH
El acetiluro metálico luego reacciona con un aldehído o cetona para formar un alcohol propargílico. Cuando un α-hidrógeno está presente (como es el caso cuando el carbonilo es un aldehído), se tautomerizará a la enona correspondiente..[3]
Los sustratos aplicables que se someten a una reacción de Favorskii están limitados en comparación con la reacción convencional porque el uso de un exceso de base de hidróxido introduce la condensación aldólica como una reacción secundaria competitiva más significativa.[2] Dado que los enolatos no reaccionan con el acetileno, la reacción a menudo puede ser un mal sustituto de la reacción convencional, especialmente cuando la reacción se usa sobre aldehídos. Las reacciones exitosas con aldehídos a menudo requieren el uso de disolventes especiales, como DMSO.[3][2] Además, el LiOH no forma el aducto necesario con los alquinos para iniciar la reacción..
Las bases de hidróxido son económicas en comparación con la generación de un alcóxido o acetiluro con reactivos tales como litio, sodio o potasio elemental. Además, las estrictas condiciones de reacción utilizadas por la mayoría de las alternativas, como la exclusión de la humedad y el oxígeno atmosférico, son menos importantes, lo que hace que la reacción sea más fácil de realizar.[3]
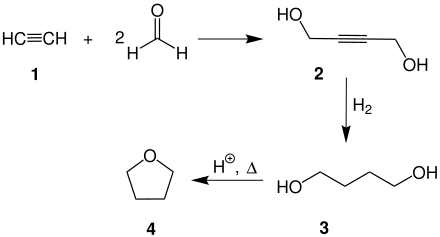
La reacción del acetileno con formaldehído forma but-2-ino-1-diol, un intermediario en la síntesis de tetrahidrofurano:
La reacción de Arens-van Dorp es un método de síntesis relacionado con la condensación de Favorskii, en donde se hace reaccionar previamente un alquinil alquil éter[4] con una base fuerte. Posteriormente, el alquinuro formado reacciona con el carbonilo de una cetona. El producto es un alcohol propargílico.[5][6]
Grupo protector[editar]
Esta reacción se usa para proteger los alquinos: el alquino se convierte con acetona en un 2-hidroxiprop-2-il-alquino o se puede sintetizar directamente un alquino protegido usando el 2-metil-3-butin-2-ol disponible comercialmente como una fuente de alquinos.[7] El grupo protector puede ser retirado calentando el compuesto en una solución de hidróxido de potasio en propan-2-ol (reacción retro-Favorskii).[8]
Véase también[editar]
Referencias[editar]
- ↑ Favorsky, A.E. (1905). «Action of potassium hydroxide on mixtures of ketones and phenylacetylene». Zhurnal Russkago Fiziko-Khimicheskago Obshchestva 37: 643-645., Favorsky, A.E. (1907). «Action de la potasse caustique sur les mélanges des cétones avec le phénylacétylène». Bulletin de la Société Chimique de France 2: 1087-1088.
- ↑ a b c Viehe, Heinz Günter (1969). Chemistry of Acetylenes (1st edición). New York: Marcel Dekker, inc. pp. 225–241. doi:10.1002/ange.19720840843.
- ↑ a b c Sobenina, L. N.; Tomilin, D. N.; Petrova, O. V.; Mikhaleva, A. I.; Trofimov, B. A. (2013). «Synthesis of secondary propargyl alcohols from aromatic and heteroaromatic aldehydes and acetylene in the system KOH-H2O-DMSO». Russian Journal of Organic Chemistry 49 (3): 356-359. doi:10.1134/S107042801303007X.
- ↑ Organic Syntheses, Coll. Vol. 4, p.404 (1963); Vol. 34, p.46 (1954). Link
- ↑ van Dorp and Arens, Nature, 160, 189 (1947).
- ↑ .J. F. Arens et al., Rec. Trav. Chim. 68, 604, 609 (1949)
- ↑ Kukula, H.; Veit, S.; Godt, A. (1999). «Synthesis of Monodisperse Oligo(para-phenyleneethynylene)s Using Orthogonal Protecting Groups with Different Polarity for Terminal Acetylene Units». European Journal of Organic Chemistry 1999 (1): 277-286. doi:10.1002/(SICI)1099-0690(199901)1999:1<277::AID-EJOC277>3.0.CO;2-R.
- ↑ Wuts, Peter G. M.; Greene, Theodora W. (2007). «Chapter 8. Protection for the Alkynes». Greene's Protective Groups in Organic Synthesis (4th edición). Hoboken, New Jersey: John Wiley & Sons, Inc. p. 932. ISBN 9780471697541. doi:10.1002/9780470053485.ch8.
