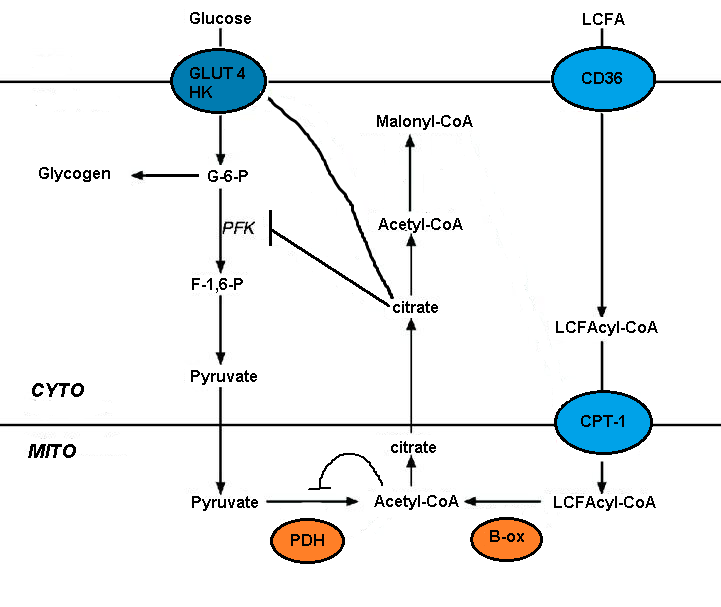
Ciclo de Randle
El ciclo de Randle, también conocido como ciclo de glucosa y ácidos grasos, es un proceso metabólico que involucra la competencia de glucosa y ácidos grasos por sustratos.[1] Se teoriza que desempeña un papel en la explicación de la diabetes tipo 2 y la resistencia a la insulina.[2][3]
Fue nombrado así por el investigador británico Philip Randle, quien lo describió en 1963.[4]
Ciclo[editar]
El ciclo de Randle es un mecanismo bioquímico que implica la competencia entre la glucosa y los ácidos grasos por su oxidación y captación en los tejidos muscular y adiposo. El ciclo controla la selección de combustible y adapta la oferta y demanda de sustrato en los tejidos normales. Este ciclo agrega un ajuste fino mediado por nutrientes además del control hormonal más grueso sobre el metabolismo del combustible. Esta adaptación a la disponibilidad de nutrientes se aplica a la interacción entre el tejido adiposo y el músculo. Las hormonas que controlan la lipólisis del tejido adiposo afectan las concentraciones circulantes de ácidos grasos, que a su vez controlan la selección de combustible en el músculo. Los mecanismos involucrados en el ciclo de Randle incluyen el control alostérico, la fosforilación reversible y la expresión de enzimas clave.[5] El balance energético de las comidas compuestas por diferentes composiciones de macronutrientes es idéntico, pero los balances de glucosa y grasa que contribuyen al balance energético general cambian recíprocamente con la composición de la comida.[6]

La glucosa se ahorra y se desvía[editar]
Estado de ayuno[editar]
Cuando se ayuna, la activación de la lipólisis proporciona ácidos grasos como fuente de combustible preferida para la respiración. En el hígado, la beta oxidación de los ácidos grasos satisface las necesidades energéticas locales y puede conducir a la cetogénesis (creación de cuerpos cetónicos a partir de ácidos grasos). Los cuerpos cetónicos se utilizan luego para satisfacer las demandas de otros tejidos además del hígado. La inhibición de la oxidación de la glucosa hace que los ácidos grasos y los cuerpos cetónicos contribuyan a un efecto ahorrador de glucosa, que es un mecanismo de supervivencia esencial para el cerebro durante los momentos de inanición. Esta inhibición de la oxidación de la glucosa a nivel de la piruvato deshidrogenasa conserva el ácido pirúvico y el ácido láctico, ambos precursores gluconeogénicos.[5]
Estado de alimentación[editar]
El ciclo de los ácidos grasos de la glucosa también se observa en el estado de alimentación después de una comida rica en grasas o durante el ejercicio. Esto es cuando aumentan las concentraciones plasmáticas de ácidos grasos o cuerpos cetónicos. La glucosa que no se oxida se desvía hacia el glucógeno. Este desvío al glucógeno explica la rápida resíntesis de glucógeno muscular después del ejercicio, así como el aumento del contenido de glucógeno en los músculos que se encuentran en la inanición o la diabetes. Este mecanismo repone los intermediarios del ciclo de Krebs.[5]
Inhibición de la vía glucolítica[editar]
El deterioro del metabolismo de la glucosa por oxidación de ácidos grasos está mediado por la inhibición a corto plazo de varios procesos glucolíticos. El grado de inhibición aumenta a lo largo de la vía glucolítica, siendo más grave a nivel de piruvato deshidrogenasa y menos grave a nivel de captación de glucosa y 6-fosfofructo-1-quinasa (PFK-1).[5] Esta secuencia ocurre debido al evento inicial, desencadenado por la oxidación de ácidos grasos, es un aumento en las proporciones mitocondriales de [acetil-CoA]/[CoA] y [NADH]/[NAD+]. Ambos sirven para inhibir la actividad de la piruvato deshidrogenasa.[7] Se ha propuesto que estos cambios dan lugar a una acumulación de citrato citosólico, que a su vez inhibe a la PFK-1, seguida de un aumento de glucosa 6-fosfato, que finalmente inhibe a la hexoquinasa.[5]
Estrés hemodinámico[editar]
El estrés hemodinámico anula la inhibición de ácidos grasos del metabolismo de la glucosa. Durante este tiempo hay una disminución en el suministro de sustrato y un aumento en la demanda de sustrato. Esto conduce a una activación de la proteína quinasa activada por AMP (AMPK) a medida que aumenta la concentración de AMP en los fluidos intracelulares y disminuye la concentración de ATP. La activación de AMPK inducida por el estrés proporciona una adaptación metabólica inmediata y protege al corazón del estrés isquémico.[5][8][9]
Inhibición de la oxidación de ácidos grasos por malonil-CoA[editar]
Malonil-CoA señala la utilización de glucosa y controla la entrada y oxidación de ácidos grasos de cadena larga (LCFA) en la mitocondria. La glucosa circulante en el hígado estimula su captación. La oxidación de la glucosa produce citrato que puede convertirse en malonil-CoA mediante la acetil-CoA carboxilasa. Malonyl-CoA inhibe la carnitina palmitoiltransferasa (CPT) que controla la entrada y oxidación de LCFA. El malonil-CoA derivado de la glucosa previene la oxidación de los ácidos grasos y favorece la esterificación de los ácidos grasos.[4][5]
Eventos citosólicos que controlan la oxidación de ácidos grasos[editar]
Concentración de malonil-CoA[editar]
La concentración de malonil-CoA depende del equilibrio entre la acetil-CoA carboxilasa (ACC) y la malonil-CoA descarboxilasa (MCD). Se informa que la proteína quinasa activada por AMP (AMPK) fosforila e inactiva el ACC hepático. Esto, a su vez, reduce las concentraciones de malonil-CoA, lo que estimula la oxidación de ácidos grasos y la cetogénesis por el glucagón en el hígado. AMPK fosforila e inactiva ACC en el hígado y otros tejidos.[10][5]
Integración de AMPK y ACC en el ciclo glucosa-ácidos grasos[editar]
La inhibición de la oxidación de ácidos grasos requiere que el ACC esté activo. Tanto AMPK como MCD están inactivos y se estimula la captación de glucosa. Los LCFA luego se desvían a la esterificación.[11] Estas condiciones existen en tejidos ricos en oxígeno, en los que la AMPK está inactiva y la glucosa inactiva la AMPK (investigada en el músculo esquelético).[12]
La inhibición de MCD suprime la oxidación de ácidos grasos y estimula la oxidación de glucosa. En un estudio en ratones deficientes en MCD, no hubo diferencia en la oxidación de ácidos grasos y glucosa en el corazón en condiciones aeróbicas. Se teoriza que la sobreexpresión de los ácidos grasos utilizados compensa la falta de MCD.[13]
Absorción de ácidos grasos[editar]
La captación de ácidos grasos de cadena larga está mediada por varios transportadores, incluido FAT (translocasa de ácidos grasos)/CD36. La deleción de CD36 rescata la miocardiopatía lipotóxica. FAT/CD36 puede controlarse con insulina y AMPK. El aumento del transporte junto con la formación de los derivados de la CoA y la activación de la AMPK resultante deberían garantizar una captación y un metabolismo eficientes de los ácidos grasos.[5]
Eventos mitocondriales que controlan la selección de combustible[editar]
Los ácidos grasos se oxidan preferentemente debido a la inactivación de la PDH por oxidación de ácidos grasos que inhibe la oxidación de glucosa. Esto sugiere que el metabolismo mitocondrial puede controlar la selección de combustible. La respiración celular es estimulada por los ácidos grasos y esto se relaciona con un aumento en la proporción mitocondrial de NADH a NAD+, lo que sugiere que la provisión de energía supera al consumo de energía. El cambio de la glucosa a la oxidación de ácidos grasos conduce a que una mayor proporción de electrones se transporten al complejo 2 en lugar del complejo 1 de la cadena respiratoria. Esta diferencia conduce a una fosforilación oxidativa menos eficiente. Al oxidar los ácidos grasos, las mitocondrias aumentan su respiración al mismo tiempo que aumentan la producción de ROS.[5]
Ácidos grasos e insulina[editar]
Los ácidos grasos pueden actuar directamente sobre las células beta pancreáticas para regular la secreción de insulina estimulada por la glucosa. Este efecto es bifásico, es decir, tiene dos fases: Inicialmente los ácidos grasos potencian los efectos de la glucosa. Después de una exposición prolongada a altas concentraciones de ácidos grasos, esto cambia a una inhibición[14] Randle sugirió que el término síndrome de ácidos grasos sería apropiado para aplicarlo al síndrome bioquímico resultante de la alta concentración de ácidos grasos y la relación con las anormalidades del metabolismo de los carbohidratos, incluyendo la inanición, la diabetes y elsíndrome de Cushing.[4]
Referencias[editar]
- ↑ Bevilacqua S, Buzzigoli G, Bonadonna R, etal (1990). «Operation of Randle's cycle in patients with NIDDM». Diabetes 39 (3): 383-9. PMID 2307295. doi:10.2337/diabetes.39.3.383.
- ↑ Shuldiner AR, McLenithan JC (2004). «Genes and pathophysiology of type 2 diabetes: more than just the Randle cycle all over again». J. Clin. Invest. 114 (10): 1414-7. PMC 525752. PMID 15545992. doi:10.1172/JCI23586.
- ↑ Delarue J, Magnan C (2007). «Free fatty acids and insulin resistance». Current Opinion in Clinical Nutrition and Metabolic Care 10 (2): 142-8. PMID 17285001. doi:10.1097/MCO.0b013e328042ba90.
- ↑ a b c Randle PJ, Garland PB, Hales CN, Newsholme EA (1963). «The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus». Lancet 1 (7285): 785-9. PMID 13990765. doi:10.1016/S0140-6736(63)91500-9.
- ↑ a b c d e f g h i j Hue L, Taegtmeyer H (2009). «The Randle cycle revisited: a new head for an old hat». American Journal of Physiology. Endocrinology and Metabolism 297 (3): E578-E591. PMC 2739696. PMID 19531645. doi:10.1152/ajpendo.00093.2009.
- ↑ Frayn K.N. (2003). «The glucose-fatty acid cycle: a physiological perspective». Biochem Soc Trans 31 (Pt 6): 1115-9. PMID 14641007. doi:10.1042/bst0311115.
- ↑ Bowker-Kinley MM, Davis WI, Wu P, Harris RA, Popov KM (1998). «Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex». Biochem. J. 329: 191-6. PMC 1219031. PMID 9405293. doi:10.1042/bj3290191.
- ↑ Kudo N, Gillespie JG, Kung L, Witters LA, Schulz R, Clanachan AS, Lopaschuk GD (1996). «Characterization of 5'AMP-activated protein kinase activity in the heart and its role in inhibiting acetyl-CoA carboxylase during reperfusion following ischemia». Biochim Biophys Acta 1301 (1–2): 67-75. PMID 8652652. doi:10.1016/0005-2760(96)00013-6.
- ↑ Goodwin GW, Taegtmeyer H (2000). «Improved energy homeostasis of the heart in the metabolic state of exercise». American Journal of Physiology. Heart and Circulatory Physiology 279 (4): H1490-H1501. PMID 11009433. doi:10.1152/ajpheart.2000.279.4.H1490.
- ↑ Randle PJ, Garland PB, Hales CN, Newsholme EA (1963). «The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus». Lancet 1 (7285): 785-9. PMID 13990765. doi:10.1016/S0140-6736(63)91500-9.<
- ↑ Clark H, Carling D, Saggerson D (2004). «Covalent activation of heart AMP-activated protein kinase in response to physiological concentrations of long-chain fatty acids». Eur J Biochem 271 (11): 2215-24. PMID 15153111. doi:10.1111/j.1432-1033.2004.04151.x.
- ↑ Itani SI; Saha AK; Kurowski TG; Coffin HR; Tornheim K; Ruderman NB (2003). «Glucose Autoregulates Its Uptake in Skeletal Muscle-Involvement of AMP-Activated Protein Kinase». Diabetes 52 (7): 1635-1640. PMID 12829626. doi:10.2337/diabetes.52.7.1635.
- ↑ ((Dyck JRB)), Hopkins TA, Bonnet S, Michelakis ED, Young ME, Watanabe M, Kawase Y, Jishage K, Lopaschuk GD (2006). «Absence of Malonyl Coenzyme A Decarboxylase in Mice Increases Cardiac Glucose Oxidation and Protects the Heart From Ischemic Injury». Journal of the American Heart Association 114 (16): 1721-1728. PMID 17030679. doi:10.1161/CIRCULATIONAHA.106.642009.
- ↑ Grill V, Qvigstad E (2000). «Fatty acids and insulin secretion». British Journal of Nutrition 83: S79-S84. PMID 10889796. doi:10.1017/S0007114500000994.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Randle cycle» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.