Cambio conformacional
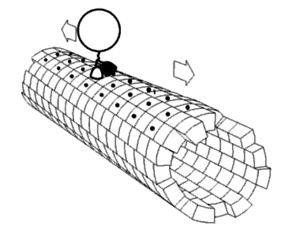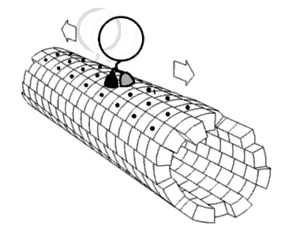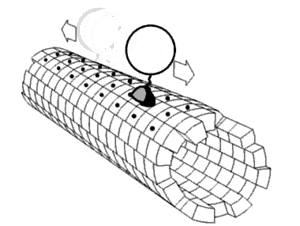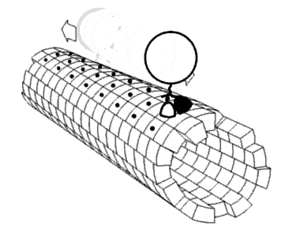
En bioquímica, un cambio conformacional es un cambio en la forma de una macromolécula, a menudo inducido por factores ambientales.
Una macromolécula suele ser flexible y dinámica. Puede cambiar de forma en respuesta a cambios en su entorno u otros factores; cada forma posible se llama conformación, y una transición entre ellas se denomina cambio conformacional. Los factores que pueden inducir tales cambios incluyen temperatura, pH, voltaje, luz en cromóforos, concentración de iones, fosforilación o la unión de un ligando. Las transiciones entre estos estados ocurren en una variedad de escalas de longitud (décimas de Å a nm) y escalas de tiempo (ns a s), y se han relacionado con fenómenos funcionalmente relevantes como la señalización alostérica[1] y la catálisis enzimática.[2]
Análisis de laboratorio
[editar]Muchas técnicas biofísicas como la cristalografía, la RMN, la resonancia paramagnética electrónica (EPR) que utilizan técnicas de etiquetado de espín, el dicroísmo circular (CD), el intercambio de hidrógeno y FRET se pueden utilizar para estudiar el cambio conformacional macromolecular. La interferometría de polarización dual es una técnica de banco capaz de medir cambios conformacionales en biomoléculas en tiempo real a muy alta resolución. Recientemente se ha aplicado una técnica óptica no lineal específica llamada generación de segundo armónico (SHG) al estudio del cambio conformacional en proteínas.[3] En este método, se coloca una sonda activa de segundo armónico en un sitio que experimenta movimiento en la proteína por mutagénesis o unión no específica del sitio, y la proteína se adsorbe o inmoviliza específicamente en una superficie. Un cambio en la conformación de la proteína produce un cambio en la orientación neta del tinte en relación con el plano de la superficie y, por lo tanto, la intensidad del segundo haz armónico. En una muestra de proteína con una orientación bien definida, el ángulo de inclinación de la sonda se puede determinar cuantitativamente, en el espacio real y en tiempo real. Los aminoácidos no naturales activos de segundo armónico también se pueden utilizar como sondas. Otro método aplica biosuperficies electroconmutables donde las proteínas se colocan encima de moléculas de ADN cortas que luego se arrastran a través de una solución tampón mediante la aplicación de potenciales eléctricos alternos. Al medir su velocidad, que en última instancia depende de su fricción hidrodinámica, se pueden visualizar los cambios conformacionales.
Ejemplos
[editar]Los cambios conformacionales son importantes para:
- transportadores ABC[4]
- catálisis[5]
- locomoción celular y proteínas motoras[6]
- formación de complejos de proteínas[7]
- canales iónicos[8]
- mecanorreceptores y mecanotransducción[9]
- actividad reguladora[10]
- transporte de metabolitos a través de las membranas celulares[11]
Véase también
[editar]- Base de datos de diversidad conformacional de proteínas
- Dinámica proteica
- La base de datos de movimientos macromoleculares (molmovdb)
Referencias
[editar]- ↑ Proteins move! Protein dynamics and long-range allostery in cell signaling 83. 2011. pp. 163-221. ISBN 9780123812629. doi:10.1016/B978-0-12-381262-9.00005-7.
- ↑ Fraser, James S.; Clarkson, Michael W.; Degnan, Sheena C.; Erion, Renske; Kern, Dorothee; Alber, Tom (3 de diciembre de 2009). «Hidden alternate structures of proline isomerase essential for catalysis». Nature 462 (7273): 669-673. ISSN 0028-0836. PMC 2805857. PMID 19956261. doi:10.1038/nature08615.
- ↑ Salafsky, Joshua S.; Cohen, Bruce (2008). «A Second-Harmonic-Active Unnatural Amino Acid as a Structural Probe of Biomolecules on Surfaces». Journal of Physical Chemistry 112 (47): 15103-15107. PMID 18928314. doi:10.1021/jp803703m.
- ↑ ABC Transporters in Microorganisms. Caister Academic. 2009. ISBN 978-1-904455-49-3.
- ↑ Kamerlin, Shina C. L.; Warshel, Arieh (1 de mayo de 2010). «At the Dawn of the 21st Century: Is Dynamics the Missing Link for Understanding Enzyme Catalysis?». Proteins 78 (6): 1339-1375. ISSN 0887-3585. PMC 2841229. PMID 20099310. doi:10.1002/prot.22654.
- ↑ Howard, Jonathan (2001). Mechanics of motor proteins and the cytoskeleton (1st edición). Sunderland,MA: Sinauer Associates. ISBN 9780878933334.
- ↑ Callaway, David J.E.; Matsui, Tsutomu; Weiss, Thomas; Stingaciu, Laura R.; Stanley, Christopher B.; Heller, William T.; Bu, Zimei (7 de abril de 2017). «Controllable activation of nanoscale dynamics in a disordered protein alters binding kinetics». Journal of molecular biology 429 (7): 987-998. ISSN 0022-2836. PMC 5399307. PMID 28285124. doi:10.1016/j.jmb.2017.03.003.
- ↑ Hille, Bertil, 1940- (2001). Ion channels of excitable membranes (3rd ed edición). Sinauer. p. 5. ISBN 0-87893-321-2. OCLC 46858498.
- ↑ Nicholl, Iain D.; Matsui, Tsutomu; Weiss, Thomas M.; Stanley, Christopher B.; Heller, William T.; Martel, Anne; Farago, Bela; Callaway, David J.E. et al. (21 de agosto de 2018). «α-Catenin Structure and Nanoscale Dynamics in Solution and in Complex with F-Actin». Biophysical Journal 115 (4): 642-654. ISSN 0006-3495. PMC 6104293. PMID 30037495. doi:10.1016/j.bpj.2018.07.005.
- ↑ Donald, Voet (2011). Biochemistry. Voet, Judith G. (4th edición). Hoboken, NJ: John Wiley & Sons. ISBN 9780470570951. OCLC 690489261.
- ↑ Singleton P (1999). Bacteria in Biology, Biotechnology and Medicine (5th edición). New York: Wiley. ISBN 978-0-471-98880-9.
