Diagrama de Moeller
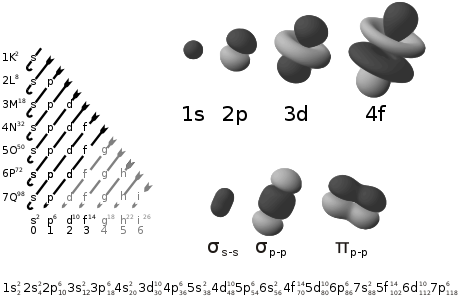
El diagrama de Moeller es una guía utilizada en química para calcular la configuración electrónica de un átomo mediante su número atómico (Z). Es aplicable en la mayoría de los elementos, con excepciones en los metales de transición y en elementos de número atómico elevado, ya que incumplen el principio de Aufbau.
Es un método gráfico y nemotécnico para aprender la regla de Madelung; esto es, cómo escribir la configuración electrónica de un elemento. Se caracteriza por trazar unas diagonales por las columnas de los orbitales, y siguiendo la dirección de la flecha se establece el orden apropiado de los mismos para un elemento.
Para comprender el diagrama se puede utilizar la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
Para encontrar la distribución electrónica se escriben las notaciones en forma diagonal desde arriba hacia abajo y de derecha a izquierda (seguir colores):
Obtención del diagrama de Moeller:
El Diagrama de Moeller recopila en una tabla una serie de datos que proporcionan los números cuánticos n (nivel de orbitales), l (Caracterización del orbital, s, p, d o f), m (orientación del orbital en el espacio), y s (espín, igual siempre a +1/2 ó -1/2).
Salvo en el caso de s, los valores de todos los números cuánticos se obtienen a partir del valor de n:
- n: NÚMERO CUÁNTICO PRINCIPAL (n), toma valores enteros positivos {1,2,3,4...}n c Z(+), ya que es el "número del nivel".
- l: NÚMERO CUÁNTICO DEL MOMENTO ANGULAR ORBITAL (l), toma todos los valores enteros desde 0 hasta (n-1) → {0,1,2,...,(n-1)}; n c Z. Caracteriza el tipo de orbital en función del nivel, n.
- m: NÚMERO CUÁNTICO MAGNÉTICO (m), toma todos los valores enteros desde (-l) hasta (+l) (incluidos los extremos) → {(-l),...,0,...,(+l)}n c Z. Indica la orientación espacial del orbital, es decir, todas sus características:
- n=1 (primer nivel de orbitales):
- l =0 → Esto da orbitales de tipo s (llamados así por la palabra sharp)
- m=0 → Un valor, una orientación, con lo que sólo hay un orbital tipo s en el nivel 1 (n=1). El orbital es, por lo tanto llamado 1s (se le añada como prefijo el valor de n).
- s= +1/2.
- n=2 (segundo nivel de orbitales):
- l=0,1:
- l=0 indica orbitales tipo s, y siempre hay uno porque para l=0, m sólo tiene un valor, 0 → El orbital es 2s.
- l=1 indica orbitales tipo p, y siempre hay 3, tantos como valores de m ({-1,0,+1}), y hay uno por cada dirección o eje en el espacio: 2px, 2py y 2pz. Llamados p de la palabra principal.
- m: si se encuentra para l=0 entonces solo tiene el valor m=0, es decir el orbital 2s. Si se encuentra en l=1 entonces hay el valor m={-1,0,1}, es decir el orbital 2p (que se puede llenar con 6 electrones)
- s: (se mantiene con sus dos mismos valores, que tienen que ver con el espín de los electrones, no con los orbitales).
- n=3 (tercer nivel de orbitales):
- l=0,1,2:
- l=0, como ya se calculó, nos da un orbital s→ 3s.
- l=1, como ya se calculó, da 3 orbitales p→ 3px, 3py y 3pz.
- l=2 indica orbitales d, y hay 5, pues m= -2,-1,0,+1,+2. Reciben los nombres: 3dz^2, 3dx^2y^2, 3dy^2z^2, 3dxy, 3dyz. Llamados d de la palabra diffuse.
- n=4 (cuarto nivel de orbitales):
- l=0,1,2,3:
- * l=0 → 4s.
- l=1 → 4px, 4py y 4pz.
- l=2 → 4dz^2, 4dx^2y^2, 4dy^2z^2, 4dxy, 4dyz.
- l=3 indica orbitales tipo f, y hay 7, pues m = -3,-2,-1,0,+1,+2,+3, con lo que hay 7 orbitales 4f. Llamados f de la palabra fundamental.
Así, y teniendo en cuenta que cada orbital tiene un máximo de 2 electrones, según el principio de exclusión de Pauli, éstos son los orbitales existentes en la configuración electrónica de los átomos, recogida de forma más sencilla en el diagrama de Moeller. Si bien hay más niveles, y, por lo tanto, más valores posibles para l, no existen en la práctica más tipos de orbitales, ya que, hasta la fecha, no ha sido descubierto ningún elemento químico cuyos átomos tengan tan elevado número de electrones como para requerir otro tipo más de orbital, algo también influido por el orden de llenado de los orbitales (véase el diagrama de Moeller, más arriba).
