Electrodo de vidrio
Un electrodo de vidrio es un tipo de electrodo selectivo de iones formado por una membrana de vidrio dopado que es selectiva a un ion específico. Estos electrodos forman una parte importante del instrumental para los análisis químicos y estudios físico-químicos en la práctica moderna. La mayor parte de los electrodos selectivos de iones (ISE, incluyendo los electrodos de vidrio); forman parte de una celda galvánica. El potencial eléctrico del sistema formado por el electrodo en solución es sensible a los cambios en la concentración de ciertos tipos de iones, la cual se refleja en la dependencia de la fuerza electromotriz producida por el sistema en relación con la concentración de esos iones.

Historia
Los primeros estudios con electrodos de vidrio encontraron que diferentes tipos de vidrios presentaban diferentes sensibilidades a los cambios en la acidez del medio (pH), debido al efecto de los iones de metales alcalinos.
- 1906 - M. Cremer determina que el potencial eléctrico que aparece entre diferentes partes de un fluido ubicado en lados opuestos de una membrana de vidrio es proporcional a la concentración de ácido (concentración de iones hidrógeno).[1]
- 1909 - S. P. L. Sørensen introduce el concepto de pH.
- 1909 - F. Haber y Z. Klemensiewicz publican en enero de 1909 los resultados de su investigación sobre electrodos de vidrio en la primera publicación de The Society of Chemistry de Karlsruhe (The Journal of Physical Chemistry by W. Ostwald and J. H. van 't Hoff) - 1909).[2]
- 1922 - W. S. Hughes demuestra que los vidrios de álcali-silicato son similares a un electrodo de hidrógeno reversible con respecto al H+
.[3]
Aplicaciones
Los electrodos de vidrio se utilizan por lo general para medir pH. También hay electrodos de vidrio especializados para la determinación de la concentración de litio, sodio, amonio, y otros iones. Los electrodos de vidrio han sido utilizados en un amplio rango de aplicaciones, desde la investigación básica y control de procesos industriales; hasta el análisis de alimentos, cosméticos y comparación de indicadores del medio ambiente; microelectrodos para la medición de los potenciales de membrana de una célula, análisis de la acidez del suelo, etc.
Tipos
Casi todos los electrodos comerciales responden a iones con una carga simple, tales como H+
, Na+
, Agl+
. El más común de los electrodos de vidrio, es el electrodo de pH. Muy pocos vidrios de calcogenuro son sensibles a los iones con doble carga, tales como el Pb2+
, Cd2+
y algunos otros iones.
Hay dos tipos principales de sistemas para la fabricación de vidrios:
- Silicato, donde la matriz está basada en una red molecular de dióxido de silicio (SiO
2) con la adición de algunos otros óxidos de metales tales como Na, K, Li, Al, B, Ca, etc.
- Calcogenuro la matriz se encuentra basada en una red molecular de AsS, AsSe, AsTe.
Iones interferentes

Debido a la naturaleza de la membrana de vidrio, de funcionar intercambiando iones, es posible que algunos otros iones interactúen concurrentemente con los centros de intercambio iónico del vidrio distorsionando la dependencia lineal del electrodo de medición con respecto al ion que está siendo medido. En algunos casos es posible incluso cambiar la función del electrodo de un ion por otro. Por ejemplo, algunos electrodos de silicato para la medición de pNa, pueden ser convertidos en electrodos de pAg sumergiéndolos en una solución de una sal de plata.
Los efectos de interferencia por lo general se describen sobre la base de la semiempírica ecuación de Nicolsky-Eisenman,[4] la cual es una extensión de la ecuación de Nernst. Esta ecuación se encuentra dada por:
Donde E es la fem, E0 el potencial estándar de electrodo, z la valencia iónica incluyendo el signo, a la actividad, i el ion de interés, j los iones interferentes, y kij el coeficiente de selectividad. Cuanto menor sea el coeficiente de selectividad, menor es la interferencia producida por j.
Par ver el efecto de interferencia del Na+
en un electrodo de pH:
Rango de un electrodo de vidrio para pH

El rango de pH a concentración constante puede ser dividido en tres partes:
- Cumplimiento completo de la función general de electrodo, donde el potencial depende linealmente del pH, comportándose como un electrodo selectivo de ion para hidronio.
Donde F es la constante de Faraday (véase ecuación de Nernst).
- Rango de error alcalino - a bajas concentraciones de iones hidrógeno (altos valores de pH), las contribuciones de los metales interfirientes tales como Li, Na, K, son comparables en magnitud a las producidas por los iones hidrógeno. En esta situación la dependencia del potencial con respecto al pH se vuelve no lineal. El efecto por lo general ya es notable a pH 12, y a concentraciones de litio o sodio de 0,1 mol/l o mayores. Los iones potasio por lo general provocan menos errores que los iones sodio.
- Rango de error ácido - a concentraciones muy altas de iones hidrógeno, la dependencia del electrodo con respecto al pH se convierte en no lineal, y la influencia de los aniones presentes en la solución comienza a ser notable. Estos efectos, por lo general, comienzan a notarse a pH menores a -1.
Hay diferentes tipos de electrodos de vidrio, algunos de ellos poseen características mejoradas para trabajar en medios alcalinos o ácidos. Pero la mayor parte de los electrodos poseen las propiedades necesarias para funcionar en los rangos de pH que van entre pH=2 y pH=12. Se pueden utilizar electrodos especiales para trabajo en condiciones especialmente agresivas.
La mayor parte de lo anteriormente escrito es también correcto para cualquier otro electrodo de intercambio de iones.
Construcción
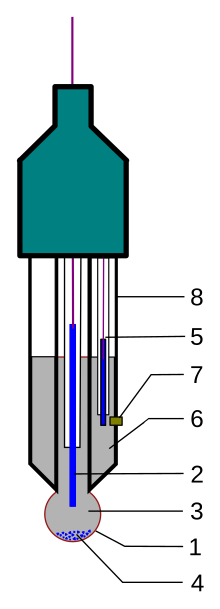
Una sonda de medición de pH moderna típicamente es un electrodo combinado, el cual contiene tanto al electrodo de referencia como al electrodo de medición dentro de un mismo cuerpo. Un electrodo combinado consta de las siguientes partes.:
- La parte sensitiva del electrodo, una burbuja hecha de un vidrio específico.
- Un electrodo interno, por lo general un electrodo de cloruro de plata o un electrodo de calomel saturado.
- Una solución interna tamponada, por lo general a pH=7 de KCl 0,1 molar para electrodos de pH, o 0,1 molar de MeCl para un electrodo pMe.
- Cuando se utiliza un electrodo de cloruro de plata, una pequeña cantidad de AgCl puede precipitar en el interior del electrodo de vidrio.
- Un electrodo de referencia, por lo general del mismo tipo que el 2.
- Una solución de referencia interna, por lo general 0,1 mol/l KCl
- Unión con la solución estudiada, por lo general hecha de cerámica, o un capilar relleno de fibra de asbestos o fibra de cuarzo.
- Cuerpo del electrodo, hecho de vidrio no conductivo o plástico.
La parte inferior del electrodo de pH termina en una burbuja redonda de vidrio delgado. El electrodo de pH, puede pensarse como un tubo dentro de un tubo. El tubo más interno, contiene una solución invariable de HCl 1×10−7 mol/l. También dentro de este tubo interno se encuentra el polo catódico de la sonda de referencia. El polo anódico se envuelve alrededor de la parte exterior del tubo interno y termina en una sonda de referencia del mismo tipo que la que se encuentra en el interior del tubo. Esta se encuentra llena con una solución de referencia de KCl 0,1 mol/l y se encuentra en contacto con la solución que se encuentra en el exterior de la sonda de pH por medio de un conducto poroso que hace las veces de puente salino.
Representación esquemática de celda galvánica
Esta sección describe el funcionamiento de dos tipos distintivos de electrodos como una unidad que combina tanto al electrodo de vidrio como al electrodo de referencia en un mismo sistema. Esto requiere algunas explicaciones.
Este dispositivo es, esencialmente, una celda galvánica que puede ser representada esquemáticamente como:
- Electrodo de vidrio || Solución de Referencia || Solución de Prueba || Electrodo de Vidrio:Ag(s) | AgCl(s) | KCl(aq) || Solución 1×10−7M de H+
|| membrana de vidrio || Solución de Prueba || unión cerámica || KCl(aq)| AgCl(s) | Ag(s)
En esta representación esquemática de la celda galvánica, se puede notar la rigurosa simetría entre los miembros del lado izquierdo y del lado derecho a partir de la columna central ocupada por la "Solución de Prueba" (la solución a la cual se le va a medir el pH). En otras palabras, la membrana de vidrio y la unión cerámica ocupan ambas la misma posición relativa en cada electrodo respectivo (electrodo de referencia y electrodo de medición). El doble símbolo "pipe" (||) encierra una barrera difusiva que evita (membrana de vidrio) o ralentiza (unión cerámica), la mezcla de dos soluciones diferentes. Al utilizar los mismos electrodos del lado derecho e izquierdo, cualquier potencial generado, depende sólo de una desigual concentración de iones a ambos lados de la membrana de vidrio.
La parte del electrodo responsable de la medición, la burbuja de vidrio situada en la parte inferior; se encuentra cubierta tanto por el interior como por el exterior por una delgada capa de un gel hidratado de aproximadamente 10 nm de espesor. Estas dos capas se encuentran separadas por una capa de vidrio seco. La estructura del vidrio de silicio (esto es la conformación de su estructura atómica) se encuentra estructurada de tal forma que permite que los iones sodio (Na+
) tengan alguna movilidad. Los cationes metálicos Na+
presentes en el gel hidratado difunden hacia la solución abandonando el gel, mientras que los iones H+
de la solución pueden difundir al interior del gel. Es este gel hidratado, lo que hace que el electrodo de pH sea un electrodo de ion selectivo.
Los H+
no atraviesan la membrana de vidrio del electrodo del pH, son los Na+
los que pueden cruzar, permitiendo un cambio en la energía libre. Cuando un ion difunde de una región de actividad a otra región de actividad, hay un cambio en la energía libre de este, y eso es lo que de hecho mide un pH-ímetro. Las membranas de gel hidratado se encuentran conectadas por el transporte de Na+
, y por lo tanto la concentración de H+
en el exterior de la membrana es "retransmitida" al interior por medio de iones Na+
.
Todos los electrodos de pH poseen una resistencia eléctrica extremadamente elevada, del orden de entre los 50 y 500 MΩ. Por lo tanto, los electrodos de vidrio solo pueden ser utilizados con instrumentos de medición con una muy alta impedancia de entrada, tales como un pH ímetro, o, más genéricamente, un voltímetro de alta impedancia de entrada, los cuales suelen ser llamados electrómetros.
Almacenamiento
Entre mediciones cualquier electrodo de vidrio o de membrana debe mantenerse en una solución de su propio ion. Por ejemplo un electrodo de vidrio debe mantenerse en una solución 0,1 mol/l de HCl o 0,1 mol/l de H
2SO
4. Esto es necesario para evitar que la membrana de vidrio se deshidrate.
Véase también
 Wikimedia Commons alberga una galería multimedia sobre Electrodo de vidrio.
Wikimedia Commons alberga una galería multimedia sobre Electrodo de vidrio.- Potenciometría
- Electrodo de ion selectivo
- ISFET electrodo de pH
- Vidrio de calcogenuro
- Electrodo de quinihdrona
Referencias
- ↑ Cremer, M. Über die Ursache der elektromotorischen Eigenschaften der Gewebe, zugleich ein Beitrag zur Lehre von Polyphasischen Elektrolytketten. — Z. Biol. 47: 56 (1906).
- ↑ F. Haber und Z. Klemensiewicz. Über elektrische Phasengrenzkräft. Zeitschrift für Physikalische Chemie. Leipzig. 1909 (Vorgetragen in der Sitzung der Karlsruher chemischen Gesellschaft am 28. Jan. 1909).
- ↑ W. S. Hughes, J. Am. Chem. Soc., 44, 2860. 1922; J. Chem. Soc. Lond., 491, 2860. 1928
- ↑ D. G. Hall, Ion-Selective Membrane Electrodes: A General Limiting Treatment of Interference Effects, J. Phys. Chem 100, 7230 - 7236 (1996) article
- Ludwig Kratz: Die Glaselektrode und ihre Anwendungen (Steinkopf, Frankfurt, 1950)

![{\displaystyle E=E^{0}+{\frac {RT}{z_{i}F}}\ln \left[a_{i}+\sum _{j}\left(k_{ij}a_{j}^{z_{i}/z_{j}}\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/173a9dcfbed1bd62faa8126ce218e846c1aabc03)

