Nitróxido

Un óxido de amina, también conocido como amina-N-óxido y nitróxido es un compuesto orgánico que contiene el grupo funcional R3N+-O−, un enlace N-O con tres enlaces adicionales a hidrógeno o a cadenas laterales de hidrocarburos unidos al nitrógeno. A veces se escribe como R3N→O.
En sentido estricto, el término óxido de amina sólo se aplica a óxidos de aminas terciarias. A veces se usa también para derivados análogos de aminas primarias y secundarias.
Ejemplos de óxidos de amina incluyen el N-óxido de piridina, un sólido cristalino soluble en agua con un punto de fusión de 62-67 °C y el N-óxido de N-metilmorfolina, que es un oxidante.
Propiedades
[editar]Los nitróxidos se usan como grupo protector para aminas e intermedios de síntesis. Los óxidos de amina de cadenas alquílicas largas se usan como surfactantes no iónicos y como estabilizadores de espumas.
Las aminas-N-óxido son moléculas altamente polares, con una polarizabilidad cercana a las de las sales de amonio cuaternario. Los nitróxidos pequeños son muy hidrofílicos y tienen una solubilidad acuosa excelente, acompañada de una solubilidad muy baja en la mayoría de disolventes orgánicos.
Los nitróxidos son bases débiles, con constantes de disociación pKa de alrededor de 4,5 , que resultan en hidroxilaminas catiónicas R3N+-OH cuando se protonan a pH inferior a su pKa.
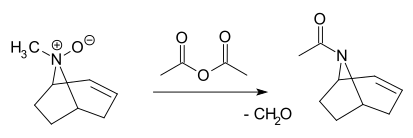
En la reacción de Polonovski un N-óxido terciario se rompe por la acción de anhídrido acético a su acetamida correspondiente y un aldehído:[1][2][3]
Síntesis
[editar]Casi todos los óxidos de amina se preparan mediante la oxidación de aminas alifáticas terciarias o N-heterociclos aromáticos. El peróxido de hidrógeno es el reactivo más común tanto en la industria como en el ámbito académico, aunque los perácidos también son importantes. Los agentes oxidantes más especializados pueden tener un uso específico, por ejemplo, el ácido de Caro o el mCPBA. Las reacciones espontáneas o catalizadas que utilizan oxígeno molecular son poco frecuentes. Algunas otras reacciones también producen óxidos de amina, como la eliminación retro-Cope, pero rara vez se emplean. En 2024, se informó de una síntesis sin catalizador de N-óxidos protonados mediante una reacción de oxidación directa de aminas aromáticas en microgotas de agua.[4]
Referencias
[editar]- ↑ Grierson, D. Org. React. 1990, 39, 85. (doi: 10.1002/0471264180.or039.02)
- ↑ M. Polonovski, M. Polonovski, Bull. Soc. Chim. France 41, 1190 (1927).
- ↑ Strategic Applications of Named Reactions in Organic Synthesis (Paperback) by Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ↑ Zhang, Xiaoping; Hu, Pinghua; Duan, Minmin; Chingin, Konstantin; Balabin, Roman; Zhang, Xinglei; Chen, Huanwen (2024). «Ambient catalyst-free oxidation reactions of aromatic amines using water radical cations». Chemical Science 15 (39): 16125-16132. PMC 11403581. PMID 39290584. doi:10.1039/d4sc04519j.
Enlaces externos
[editar]- Chemistry of amine oxides
- Surfactants, types and uses Archivado el 31 de julio de 2020 en Wayback Machine. (pdf)
- The amine oxides homepage
- Nomenclature of nitrogen compounds
- IUPAC definition (pdf)