Usuario:Trufy23/Ecología del Estuario de San Francisco
El estuario de San Francisco junto con el Río de Sacramento y el Río de San Joaquín representa un ecosistema altamente alterado. Esta región ha sido gravemente arreglada para acomodarse a las necesidades de entregar agua, agricultura y el desarrollo de los suburbios. Estas necesidades han llevado a que haya cambios directos en el movimiento del agua y en la naturaleza del paisaje y cambios indirectos de la introducción de especies no nativas. Nuevas especies han alterado el ambiente de las islas y los canales que forman el sistema complejo conocido como Delta.[1]
Este artículo trata particularmente con la ecología de la zona con baja salinidad (ZBS) del estuario. La reconstrucción de una red alimenticia histórica para la ZBS es difícil por distintas razones. Primero, no hay un registro claro de las especies que históricamente han ocupado el estuario. Segundo, el estuario y el delta han estado en la transición geológica e hidrológica durante la mayor parte de su historia de 10,000 años y así describir la condición "natural" del estuario es como "darle a un blanco móvil".[1] El cambio climático, la ingeniería hidrológica, el agua en constante cambio y las especies recién introducidas seguirán alterando la configuración de la red alimenticia del estuario. Este modelo proporciona una imagen instantánea del estado actual, con notas sobre cambios recientes o introducciones de especies que han alterado la configuración de la red alimenticia. La comprensión de la dinámica de la red alimenticia actual puede resultar útil para los esfuerzos de restauración para mejorar el funcionamiento y la diversidad de especies en el estuario.
Geografía física[editar]
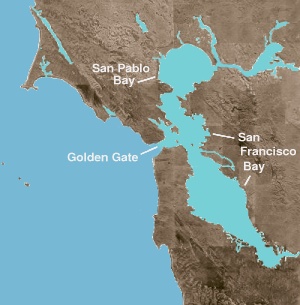
La bahía de San Francisco (San Francisco Bay) es a la vez una bahía y un estuario. El término anterior se refiere a cualquier entrada que proporciona un refugio físico desde el océano. Un estuario es una característica fisiográfica donde el agua dulce encuentra un océano o un mar. En la parte norte de la bahía se encuentra un estuario de agua salubre, que consiste en una serie de balsas físicas que están dominadas por los flujos de agua dulce y flujos de aguas marinas. Estas entidades geográficas se mueven de salina a fresca (o de oeste a este): Bahía de San Pablo, inmediatamente al norte de la Bahía Central; el estrecho de Carquinez, un canal estrecho y profundo que conduce a la bahía de Suisun; y el delta de los ríos Sacramento y del río San Joaquín.
Hasta el siglo XX, la ZBS del estuario estaba rodeada por fangos de agua dulce. Entre el 80 y el 95% de estos fangos históricos han sido llenados para facilitar el uso de la tierra y el desarrollo alrededor del área de la Bahía.[2] Se cree que la pérdida de hábitat en los bordes de esta zona crea una pérdida de especies de peces pelágicos nativos, aumentando la vulnerabilidad a la depredación.
El estuario intertidal y bentónico actualmente está dominado por el lodo que son, en gran parte el resultado de la sedimentación derivada de la explotación minera en la Sierra Nevada a finales del siglo XIX. La tendencia hacia elevadas cargas de sedimentos se invirtió en la década de 1950 con el advenimiento del Proyecto del Valle Central, bloqueando la mayoría de los sedimentos detrás de las presas y dando como resultado una pérdida neta anual de sedimentos del estuario.[3] Por lo tanto, los fangos parecen estar retrocediendo lentamente, aunque el agua turbia sigue siendo extremadamente alta. La alta del agua es responsable de la condición única que existe en el estuario de San Francisco, donde la disponibilidad de nutrientes no conduce a una alta producción de fitoplancton. En lugar de esto, la mayoría de los organismos fotosintéticos de algas tienen luz limitada.[4]
El Delta también ha sufrido grandes alteraciones. Desde el siglo XIX, los diques naturales se reforzaron para que fueran permanentes, para proteger las tierras de cultivo de las inundaciones regulares. Muchas de estas granjas se establecieron en las islas donde se encuentran en medio de las vías fluviales del Delta. La agricultura intensiva oxidó el alto contenido de carbono del suelo, causando una pérdida considerable de masa. Como consecuencia, estas islas han descendido con el tiempo o se han hundido, a casi 6 metros bajo el nivel del mar.[5] El Delta se compone hoy en día de vías de agua altamente contaminada, puntuado por las islas que aparecen como "cuencas flotantes" con estas cuencas por debajo de la superficie del agua.[6] Estas islas corren un alto riesgo de que ocurran inundaciones debido al colapse de los diques. Se espera que el cambio hacia el este de la salinidad cambie drásticamente la ecología de toda la ZBS del estuario de San Francisco.[7]
Hidrodinámica[editar]

El ZBS se centra alrededor de 2 ups (unidades prácticas de salinidad, una medida de salinidad) y oscila entre aproximadamente 6 ups a 0.5 ups. Los principales aportes de agua dulce al estuario provienen del escurrimiento de las precipitaciones regionales, del río de Sacramento y del río San Joaquín.[8]
La afluencia de los ríos se controla en gran medida por las liberaciones de los embalses en aguas arriba. Una parte significativa de este flujo de entrada se exporta fuera del Delta por el Proyecto Central del Valle Central y el Proyecto de Agua del Estado al sur de California para uso agrícola y urbano. Estas alteraciones han eliminado una gran parte de la variación en el flujo de salida del estuario (es decir, el agua dulce que sale del Golden Gate), creando una salida más baja en el invierno y una salida más alta en el verano, que se puede ver gracias a los reportes históricos. El fitoplancton, el zooplancton y los peces larvarios y adultos pueden arrastrarse en la exportación, causando un impacto muy significativo pero desconocido en la abundancia de estos organismos. Esto puede ser particularmente cierto del delta smelt (una especie de pez) en peligro de extinción, un pequeño pez endémico; excepto que se ha descrito como abundante en gran parte en los relatos históricos.[9] Se cree que el delta smelt migra y se cría aguas arriba en el Delta durante el comienzo del verano, poniendo sus huevos y larvas en alto riesgo.[10] La gestión para el pez smelt es actualmente una gran fuente de controversia ya que su ecología se contrapone a las necesidades de la conservación del agua, el desarrollo y la agricultura en California.
El movimiento de agua fuera del estuario es complejo y depende de una lista de factores. Los ciclos de marea hacen que el agua se mueva hacia y lejos del Golden Gate cuatro veces en 24 horas.
Utilizando 2 ups como marcador para la ZBS, la dirección y la magnitud de las fluctuaciones se pueden seguir como su distancia en kilómetros del Golden Gate, o X2. Debido a que la posición de X2 se basa en una serie de parámetros físicos, incluyendo la entrada, la exportación y las mareas, su posición se desplaza a lo largo de muchos kilómetros en un ciclo diario y estacional; en el curso de un año, puede extenderse de la bahía de San Pablo durante períodos donde el flujo es alto y para arriba en el delta durante la sequía del verano. La posición de X2 es monitoreada cuidadosamente y mantenida ya que se liberan embalses de agua en previsión de la demanda de exportación. Esto es obligatorio por la Junta Estatal de Agua de 1641 y requiere que el bombeo estatal y federal sea reducido si X2 es desplazado al este de la isla Chipps (75 kilómetros río arriba del Golden Gate) durante los meses de febrero a mayo o al este de Collinsville. 81 kilómetros río arriba del Golden Gate) durante los meses de enero, junio, julio y agosto. (1641, pp. 150)
La circulación gravitacional provoca que el agua estratificada de alta salinidad profunda pueda fluir hacia la tierra, mientras que el agua de baja salinidad en la parte superior puede fluir hacia el mar.[11] El efecto de la circulación gravitacional puede ser más notable durante los períodos de flujo de agua dulce, proporcionando una retroalimentación negativa para mantener el campo salino y la distribución de organismos pelágicos en el estuario.
La mezcla es importante en el borde terrestre de la circulación gravitatoria, a menudo alrededor de X2, donde la columna de agua se vuelve menos estratificada.[12] Una zona de fija mezcla se produce en el "Benicia Bump" en el extremo este del Estrecho de Carquinez, donde el canal que ya es profundo se vuelve dramáticamente aún más profundo al entrar en la Bahía de Suisun.[13] La mezcla es fundamental para mantener la salinidad de manera que se requieran entradas extremadamente grandes de agua dulce para mover X2 a una corta distancia hacia el oeste. La mezcla también ayuda a los organismos pelágicos a mantener la posición en el estuario,[1] frenando la advección de la producción primaria y secundaria fuera del sistema.
Zona pelálgica[editar]
Los organismos pelágicos pasan toda su vida o una parte de sus vidas en aguas abiertas, donde el hábitat se define, no por los bordes, sino por la tolerancia fisiológica a la salinidad y la temperatura. La ZBS del Estuario de San Francisco constituye un hábitat para una serie de organismos que se especializan para sobrevivir de confluencia terrestres, de agua dulce y marinas. Como se puede ver hay muchos hábitats con distintas ecologías que forman parte del estuario (incluídos los sistemas marinos, de agua dulce, pantanos intermareales y sistemas de fango bentónico), cada uno está vinculado a la ZBS mediante la exportación e importación de agua dulce, nutrientes, carbono y organismos.[1]
La distribución y abundancia de organismos en la ZBS depende de factores abióticos y bióticos. Los factores abióticos incluyen la geografía física y la hidrología del estuario, incluidos los insumos de nutrientes, la carga de sedimentos, la turbiedad, la estocasticidad ambiental, el clima y las influencias antropogénicas.[8] Los factores abióticos tienden a impulsar la producción en el ambiente estuarino y están mediados por factores bióticos.
Los factores bióticos incluyen la absorción de nutrientes y la producción primaria, la producción secundaria de zooplancton, la red alimenticia y la dinámica trófica, la transferencia energética, la advección y la dispersión dentro y fuera del sistema, la supervivencia y la mortalidad, la depredación y la competencia de las especies introducidas.
Red alimenticia[editar]

Es difícil caracterizar la histórica red alimenticia del estuario de San Francisco debido a los dramáticos cambios en geografía, hidrología y composición de especies que se han ocurrido en el siglo pasado. Sin embargo, el monitoreo iniciado en la década de 1970 da cierta información sobre la dinámica histórica de la red de alimentos. Al principio de los años 70, la ZBS estaba dominada por una fibra alimenticia que empezaba con el fitoplancton, una población estable de mesoplanconía dominada por el copépodo Eurytemora affinis y un macrozooplancton grande tipificado por camarones de la Bahía de San Francisco y camarones mísidos (mysid shrimps).[14] Estos proveeron de nutrición y energía a los alimentadores como la anchoa septentrional (Engraulis mordax) y planktivores como el delta smelt y el salmón juvenil.
El cambio constante de la red alimenticia ha sido impulsado históricamente por el aumento de la turbiedad y más recientemente, por las especies introducidas, tal como se describe en las secciones sobre producción primaria y producción secundaria.
Notablemente, la tasa tan elevada de la población de Potamocorbula amurensis de la almeja del río Amur ha producido una disminución de diez veces en la densidad del plancton, resultando una trampa de carbono para los bentos y un aumento en la producción de resuidos de detritos. [15] Este desperdicio de energía microbial, da como resultado un aumento en el microplancton como el Limnoithona tetraspina, que se ocupara con los ciliados.
Estos cambios son una de las causas de la disminución de la población de peces. Por ejemplo, la anchoveta del norte, Engraulis mordax, fue hasta los años 80, que era bastante abundante en la ZBS, hasta que el rango en el estuario se restringió a la Bahía Central y la Bahía del Sur. Esto se debe probablemente a una respuesta de comportamiento después de la introducción de la almeja del río Amur (Potamocorbula amurensis) y la disminución en la disponibilidad de plancton como consecuencia.
Más recientemente, se describió un descenso general del organismo pelágico (DGO) y esto ha sido un motivo de gran preocupación en las comunidades científicas, gerenciales y políticas.[16]
Varias especies claves, incluyendo el delta smelt, el eperlano, el bajo rayado y el sábalo de hilachas han sido declaradas "especies de interés" debido a una disminución gradual de la abundancia a partir de 2001.[17] A esto se suma una disminución similar en la productividad secundaria y actualmente es la fuente de muchas investigaciones. Se han hecho una serie de hipótesis para explicar el DGO, incluyendo el deterioro de la red alimenticia, las exportaciones de agua del Delta y los tóxicos provenientes de fuentes urbanas, industriales o agrícolas.
Productores[editar]
Producción primara[editar]
La producción primaria por el fitoplancton arregla la energía y los alimentos primordiales en una forma biológicamente disponible (alimento), vía fotosíntesis. La producción de fitoplancton está estructurada en gran medida por parámetros físicos: disponibilidad de nutrientes, luz solar, turbiedad y temperatura.
El estuario de San Francisco cuenta con numerosas fuentes de nutrientes que pueden utilizarse para la producción primaria, derivadas principalmente de las instalaciones de tratamiento de aguas residuales, el drenaje agrícola y urbano y claro, el océano.[18][19] A pesar de esto, el estuario es único en que tiende a tener una tasa relativamente decresciente de producción primaria.[20] Esto se debe probablemente a dos factores: aportes de nitrógeno en forma de amonio, lo que suprime la absorción de nitratos por el fitoplancton, que prefieren el NH4 porque metabólicamente es más barato y alta turbiedad, que limita la luz necesaria para la fotosíntesis a los pocos centímetros superiores del agua.[19] Esta turbiedad es un legado de la minería hidráulica en la Sierra Nevada en 1850.[21]
El tiempo tan largo de permanencia del agua en el estuario tiende a permitir que la biomasa del fitoplancton se acumule, incrementando la densidad, mientras que el tiempo bajo en el agua elimina al el fitoplancton del estuario.[1] Este último es típico de los principales canales del río durante los períodos de alto flujo, cuando las aguas superficiales tienden a nivelar las partículas y el plancton aguas abajo.
La herbivora también elimina el fitoplancton de la columna de agua. Mientras que la red alimenticia pelágica se basa en la producción de fitoplancton, la mayor parte de esta producción se desvía al bentos a través de la depredación por la almeja del río Amur (Corbula amurensis). Los niveles de biomasa del fitoplancton decrescieron en órden de magnitud después de la introducción generalizada de C. amurensis a mediados de los años ochenta y no se han recuperado.[22]
Producción fotosintética[editar]
La principal fuente de energía derivada de la fotosíntesis es el fitoplancton. En general, las diatomeas y los microflagelados producen la mayor parte del carbono biodisponible en el estuario.[23] Otros tipos, notables de dinoflagealdos, pueden producir peligrosas algas, que son menos aceptadas en la red alimenticia.[24]
La producción primaria del fitoplancton es un función de dos distintos factores: la tasa de crecimiento y la acumulación. (Figura 1). Aunque el ZBS es un para altas concentraciones de nutrientes de fuentes urbanas y agrícolas, las tasas de producción del fitoplancton son muy bajas.[25] El nitrato es utilizado por el fitoplancton para el crecimiento, pero el amonio (derivado de los vertidos de aguas residuales) tiene un efecto supresor sobre la tasa de crecimiento. Aunque no son limitados por los nutrientes, el fitoplancton tiende a crecer de una manera lenta ya que hay distintas clases de nitrógeno presente.[26] Otro factor supresor en la tasa de crecimiento es la alta turbidez del estuario, que limita la capacidad de la radiación fotosintéticamente activa (RFA) para pasar más allá de la superficie del agua. Esto limita la fotosíntesis del fitoplancton a una zona fótica que es poco profunda. Por lo tanto, cuando la columna de agua está estratificada, la turbidez es alta y el amoniaco está presente, la tasa de crecimiento del fitoplancton suele ser por una gran parte eliminada.[27][28]
La acumulación de fitoplancton es principalmente el resultado de todo el tiempo de residencia.[25] El Delta Norte y la Bahía de Suisun tienen tiempos de residencia bajos debido al alto volúmen de agua que se mueve a través de la región para el flujo agua. Dado que el agua se mueve más rápidamente a través de esta parte del sistema, la velocidad de acumulación disminuye a medida que la productividad se advierte fuera del sistema. Por otro lado, la parte del Delta tienen un tiempo de residencia más alto debido al bajo volumen de agua que se mueve por el sistema; de hecho el agua en algunas situaciones corre para atrás, debido a la falta de flujo desde el río San Joaquín y el bombeo de exportación. Durante el verano, la densidad del fitoplancton puede ser un orden de más grande magnitud que en otras partes del estuario.[29]
Las floraciones de algas nocivas (FAN) de dinoflagelados o cianobacterias producen subproductos metabólicos tóxicos que son nocivos para otros organismos. Con una combinación de altas concentraciones de nutrientes y distintas temperaturas, las FAN tienen un efecto negativo en la red alimenticia al excluir competitivamente diatomeas y microflagelados, reduciendo aún más la producción primaria biodisponible. Aunque algunos invertebrados como los bivalvos no pueden estar afectados, pueden expandir toxinas en la cadena alimenticia, enfermar o matar a los depredadores. Aún no se sabe bien de que manera afectan a los copépodos. Las algas invasoras microcystis aeruginosa son bastante comunes en el delta durante el verano y pueden reducir la productividad del copépodo (además de ser potencialmente cancerígenos para los humanos).[30]
Producción detrital[editar]
Enormes cantidades de sedimento pasan a través de la ZBS. Mucho de esto es de desechos orgánicos, es materia orgánica disuelta y en partículas (MDP y PDM, respectivamente). Además de las fuentes de las aguas arriba, la materia orgánica puede acumularse a partir de la muerte de los organismos locales y la producción de residuos.[31][32]
Los detritívoros capitalizan esta fuente de energía, creando una red alimenticia alterna y paralela de gran importancia. Esto se debe a que la fijación de carbono en la red de alimentos detríticos no está limitada por la estratificación, la turbidez o las 24 horas del día, estos factores limitan la fotosíntesis. La producción de detritos se produce de forma continua, limitada sólo por insumos y advección fuera del Delta.[23][33]
Las bacterias son los principales agentes de transformación de MDP y PDM en carbono biodisponible a través del lazo microbiano. Este mecanismo es importante en sistemas marinos que contienen nutrientes limitados, donde las bacterias liberan nutrientes de los detritus hundidos, permitiendo que sean reciclados de nuevo a la zona fótica. Muy poco trabajo se ha aplicado a la función del lazo microbiano en el estuario de San Francisco, pero el papel de las bacterias no es fundamental para el reciclaje de los nutrientes en un sistema eutrófico. Sin embargo, puede proporcionar una cadena alimenticia alternativa a través del proceso directo por los flagelados, los rotíferos y los ciliados.[34]
La gran abundancia del copépodo ciclopoide limnoithona tetraspina puede deberse a su dependencia de los ciliados en lugar del fitoplancton como fuente primaria de alimento.[35] Las principales especies de copépodos calanoides también pueden utilizar a los ciliados como una fuente suplementaria o incluso primaria de alimento, por otro lado se desconoce hasta que grado puede suceder esto.[36][37]
Producción secundaria[editar]
La producción secundaria son los organismos que se alimentan de la producción primaria y transfieren de energía a los niveles tróficos más altos de la red de alimenticia de los estuarios. La producción secundaria en el Estuario de San Francisco estuvo denominada por la producción de camarón.[38][39] Sin embargo, el mysid Neomysis mercedis ha sido reemplazado en gran parte por el Acanthomysis bowmani introducido, que permandece en bajas densidades. El anfípodo Gammurus daiberi introducido por haber formado parte de este nicho, pero se limita al agua dulce.
Actualmente la principal fuente de producción secundaria se deriva de copépodos. Se cree que el copépodo calanoide nativo natural (Eurytemora affinis) se introdujo en el siglo XIX.[40] El zooplancton fue el que dominó la ZBS hasta 1980, cuando fue reemplazado en gran parte por otro copépodo calanoide introducido, Pseudodiaptomus forbesi.[41][42] P. forbesi mantiene una población en las regiones de agua dulce del estuario, en el Delta, muy por debajo del rango de tolerancia a la salinidad de la almeja del río Amur.[43] Debido a que el E. affinis, carece de un rango ascendente, es más vulnerable a que la almeja se su deparadora y tiene gran competencia con P. forbesi.
Otros copépodos calanoides tienen gran importancia son el Sinocalanus doerri y el Acartiella sinensis. Poco se sabe sobre la vida de estos organismos y pueden presa de otros copépodos. Aparecen en ciclos irregulares de abundancia, durante los cuales pueden ser el depredador del zooplancton.[44]
Otro copédodo invasor, es el ciclopoide Limnoithona tetraspina, el cual apareció en la ZBS en los 90. Desde entonces, L. tetraspina se ha convertido en el copépodo dominante por su abundancia en el estuario, alcanzando densidades del orden de 10,000/m3. Se basa en el lazo microbiano como su principal fuente de alimento, alimentándose de bacterias, ciliados y rotíferos.[35] Además, parece invulnerable a la depredación por la almeja del río Amur, por razones que se desconocen. Por su pequeño tamaño L. tetraspina generalmente no se encuentra disponible para el consumo de grandes depredadores, particularmente el pescado, lo que lo convierte en un energético final.
Consumidores[editar]
Consumidores primarios[editar]
Los consumidores primarios dependen basicamente de la producción primaria como fuente de alimentos principal. Los consumidores mñas importantes de la red pelágica de la ZBS son los copépodos, después los rotíferos, los flagelados y los ciliados como ya mencionamos anteriormente. Todas estas especies de copépodos calanoides han disminuidos debido a la presión alta de la depredación de la almeja del río Amur (Corbula amurensis).[41] Debido a esto, y debido a los copepódos que se basan en las fuentes primarias de alimentos fotosintéticos y detríticas que existen en la ZBS y tienen poca retroalimentación, a diferencia de otros sistemas marinos.
El Pseudodiaptomus forbesi es el copépodo dominante de la ZBS. Tiene suficiente tolerancia para persistir en baja salinidad como en el agua dulce. Esta distribución tan amplia ayuda a la población a mantener refugio de la depredación, no como otras especies con tolerancias de salinidad más reducidas.[43]
La Limnoithona tetraspina se ha convertido en el copépodo dominante por su cantidad desde 1993 en su introducción. Se alimenta principalmente de los ciliados y microflagelados, pero a diferencia del P. forbesi, es relativamente imprevisto para la depredación por almejas o peces; por eso su abundancia. Energéticamente L. tetraspina podría no existir la salida de la red alimenticia; ya que estos copépodos son sacados del sistema por las mareas y las corrientes, o se mueren y caen en los bentos, donde está el ciclo microbiano.[45]
Copépodos depredadores[editar]
Existen varios copépodos depredadores en todo el Delta, de los cuales se sabe relativamente poco. Sinocalanus doerri, Acartiella sinensis y Tortanus dextrilobatus parecen ser morfológicamente capaces de predación sobre otros copépodos. Cada uno fue introducido al estuario, a través del intercambio de agua de lastre desde los años 80. Generalmente, no tienen abundancia suficiente para impactar negativamente a los consumidores de copépodos; sin embargo, se producen floraciones periódicas de S. doerri y A. sinensis, las cuales aún no han sido bien estudiadas[46]
Macroinvertebrados[editar]

Aunque son capaces de alimentarse por filtración, los mísidos (criaturas minúsculas como el camarón) son en gran parte carnívoros, alimentándose de algunos copépodos mayores. Proporcionan un conducto energético entre el plancton y los peces planctívoros, incluyendo peces juveniles, esturión, salmón Chinook y sábalo americano. Los mísidos fueron abundantes hasta que el nativo de Neomysis mercedis fue reemplazado a mediados de 1980 por la invasiva Acanthomysis bowmani, el cual es más pequeño y menos abundante. Esta descendencia de los mísidos se ha relacionado con la anterioridad de la disminución de varias especies de peces en el estuario en los 80s y 90s.[47][48]
Los camarones generalmente, son carnívoros que se aprovechan de los mísidos y los anfípodos. Crangon franciscorum representa una de las dos partes de pescadería comerciales restantes en el estuario. Ya no se utiliza para los "cócteles de camarón de San Francisco Bay", que se cosechan para el cebo.[49]
Peces[editar]

Debido a que los peces son un grupo taxonómico y morfológicamente diverso, las especies varían en sus ecologías del trófico. En general, los peces pueden dividirse en cuatro categorías de alimentación: alimentadores de filtro, planctivoros, piscivoros y bentónicos.
Los filtros de alimentadores depuran la columna de agua indiscriminadamente para las presas pequeñas, típicamente fitoplancton y zooplancton. Esta categoría de peces incluye sábalo (Dorosoma petenense), sábalo americano (Alosa sapidissima), silvesteres (Menidia beryllina) y anchoas (Engraulis mordax). Algunas evidencias sugieren que algunas de estas especies están limitadas por alimentos debido a los niveles deprimidos del plancton después de la introducción de la almeja del río Amur. Las anchoas han dejado la ZBS en favor de las regiones más productivas del estuario en la Bahía San Pablo y la Bagía Central.[15]
Los planctivoros atrapan a sus presas selectivamente como sería del zooplancton individual, copépodos, mísidos y gammaridos. En este grupo se incluyen la mayoría de las larvas de peces, el delta smelt (Hypomesus transpacificus) y el olivo largo (Spirinchus thaleichthys), la tule percha (Hysterocarpus traski) y el salmón smolt. El delta smelt es de particular interés debido a su estado en peligro de extinción. Puede ser limitado en cuanto la alimentación, pero es contradictoria la evidencia. Otros factores, como el arrastre de huevos y larvas en el bombeo de agua dulce del Delta por parte de la exportación, también puede explicar la disminución de estos.[10]
El piscivoro principal de la ZBS es el bajo rayado (Morone saxatilis), que se introdujo en 1890 y sus presas son en gran medida los peces nativos. El bajo rayado es muy importante para la pesquería deportiva en el estuario de San Francisco y como tal, representa muy poco de la biomasa del estuario.[50]
Los peces bentónicos, incluyen esturión blanco (Acipenser transmontanus), bagre blanco (Ameiurus catus) y platija estrellada (Platichthys stellatus). Debido a su orientación de hábitat, se alimentan principalmente de organismos epibentónicos como anfípodos, camarones de bahía y bivalvos. Estos peces se alimentan de la almeja del río Amur, lo que representaría uno de los pocos canales para el flujo de energía de esa especie, excepto la producción detrítica.[51]
La pesquería comercial en el ZBS es para el camarón del cebo. Existen varias pesquerías deportivas que representan un flujo menor de carbono, pero un significativo flujo de capital a la economía local alrededor del estuario. La mayoría de las pesquerías recreativas rodean el bajo rayado, el esturión y los bajos de agua dulce del Delta de agua dulce. Esta escaséz de pesquerías hace que el estuario de San Francisco sea único. Casi todos los estuarios del mundo apoyan a las pesquerías.[52] El estuario de San Francisco por un tiempo apoyó las principales pesquerías de salmón, anchoas y cangrejos de Dungeness hasta 1950. La desaparición de estas pesquerías se debió más a la desaparición del hábitat que a la sobreexplotación.[2]
Aves[editar]
El estuario de San Francisco es una importante parada en la ruta del Pacífico para la migración de las aves acuáticas. Sin embargo, se sabe muy poco acerca del flujo de carbono dentro y fuera del estuario por las aves. Millones de aves acuáticas usan anualmente la bahía como refugio. La mayoría de las aves son los patos los cuales se alimentan de la vegetación acuática. Los "patos de buceo" se alimentan de organismos epibentinos como C. amurensis, lo que representa un posible flujo de carbono al final de ese extremo.[53][54] Dos especies de aves en peligro de extinción se encuentran aquí: el tern menor de California y el carril de chapaleta de California. Ambos lados que están expuestos de la bahía proporcionan áreas de alimentación importantes para las aves, pero las capas subyacentes del lodo de la bahía plantean peligros geológicos para las estructuras cerca de la bahía. Los pájaros piscívoros como cormoranes y pelícanos también habitan el estuario, pero su impacto trófico aún no ha sido estudiado del todo.
En enero del 2015, los científicos estaban trabajando para identificar una sustancia gruesa, pegajosa e inodora que recubría a las aves a lo largo de las costas de la Bahía de San Francisco. Cientos de aves han muerto y cientos más han sido cubiertas por esa sustancia. Los científicos están preocupados por otras especies silvestres que pueden estar en contacto con la sustancia y así ponerlos en riesgo.[55]
Mamíferos[editar]


Antes de 1825, españoles, franceses, ingleses, rusos y americandos iban a la bahía para cosechar cantidades muy grandes de castor (Castor canadensis), nutria de río, marten, pescado, zorro, comadreja, lobos marinos (Callorhinus ursinus) y nutria de mar (Enhydra lutris). Este comercio de pieles en ese tiempo, conocido como "la fiebre de la piel de California", era el responsable de abrir la bahía de San Francisco, al comercio a nivel mundial.[56] Para 1817 la nutria marina estaba practicamente extinta.[57] Los rusos mantuvieron una estación de sellado en las Islas Farallón (1812 - 1840), llevando de 1,200 a 1,500 focas anualmente, aunque los barcos estadounidenses ya habían explotado las islas.[58] Para 1818, las focas disminuyeron rápidamente hasta que sólo pudieron cazar alrededor de 500 anualmente y en los próximos años, la foca fue eliminada de las islas hasta que comenzaron a recolonizar las islas en 1996.[59] Aunque los naturalistas del siglo XX eran escépticos de que el castor estuviera históricamente presente en los arroyos costeros o en la propia Bahía,[60] registros antiguos mostraban que el castor dorado de California (Castor canadensis) fue uno de los más valorados en la bahía, y al parecer se encontraba en gran cantidad.[56] Thomas McKay informó que en un año la Compañía de la Bahía de Hudson tomó 4,000 pieles de castor en las costas de la Bahía de San Francisco. A la fecha, el castor ha recolonizado el Napa Sonoma Marsh en la bahía del norte de San Pablo y sus afluentes de Sonoma Creek y del río Napa. También recientemente regresó a la Bahía, la nutria de río de América del Norte (Lontra canadensis) se informó por primera vez en Redwood Creek en Muir Beach en 1996,[61] y recientemente en Corte Madera Creek y en la Bahía del sur en Coyote Creek,[62] así como en 2010 en la Bahía de San Francisco en Richmond.
Medusa[editar]
Las medusas no han prevalecido en el estuario hasta hace poco. En los estuarios de la costa este como en la Bahía de Chesapeake, a menudo son depredadores de alto nivel, alimentándose indistintamente de peces y zooplancton. Varios taxones invasores pequeños han sido identificados en la ZBS y las regiones de agua dulce. Estas especies se estrobilizan en verano, pero mantienen pólipos durante todo el año.
Su impacto en el plancton es desconocido, pero la investigación está en marcha para cuantificarlo. En la densidad suficiente, las jaleas pueden tener un papel complementario a C. amurensis en la supresión del zooplancton, al habitar áreas de baja salinidad fuera del rango de las almejas, donde las especies planctónicas han tenido un refugio libre de depredación.
Consumidores bentónicos[editar]
La comunidad bentónica ha asumido un papel desproporcionadamente grande en la ecología de la red alimenticia del estuario debido a invasiones claves por los bivalvos.[41] El uso de estas almejas, tiene una amplia tolerancia a la salinidad que se extiende en la ZBS, pero no en agua dulce. El filtro es alimentado de fitoplancton y de zooplancton, como los nauplios de los copépodos calanoides. La almeja tiene pocos depredadores en el estuario de San Francisco y esto le permite crecer a altas densidades. Es capaz de limpiar una parte del agua del estuario en pocos días, lo que lleva a la poblaciones de plancton que se agoten drásticamente.[63] Se cree que es la principal causa de una disminución de la productividad de los ecosistemas después de la invasión de las almejas a mediados de los años 80.[41][64][65]
Esta disminución de productividad se debe esencialmente a la reorientación de la red pelágica de una cadena béntica por esta especie.[41] Debido a que la almeja del río Amur se alimenta de productores primarios, consumidores y depredadores, afecta a múltiples niveles tróficos. En consecuencia, casi todo el plancton muestra signos de competencia, ya que la producción a un nivel trófico afecta a todos los demás aumentando la abundancia de almejas. Esto da como resultado una curva de retroalimentación negativa: C. amurensis limita la biomasa del plancton, que a su vez limita a C. amurensis. Sin embargo, los insumos de fuera del sistema debido a la advección de las mareas o las fuentes aguas arriba pueden aumentar la biomasa de C. amurensis, conduciendo además a la limitación del plancton. Este ciclo de retroalimentación se amplifica porque la almeja puede resistir durante más de uno o dos años, lo que aumenta la presión sobre las poblaciones de plancton durante ciclos de baja productividad.
La reorientación del carbono por C. amurensis hacia el bentos ha creado una cadena limitada. La producción de detritos a partir del excremento de almejas y de la muerte de estas espeices puede alimentar la producción bacteriana, la cual puede hacer que la red circule con alimentos distintos.
Mientras que los nutrientes reciclados pueden soportar cierto crecimiento de fitoplancton, al final se alimenta para aumentar las poblaciones de C. amurensis. El éxito reciente de la invasión de Limnoithona tetraspina se toma como un fenómeno. Se alimenta de ciliados y microflagelados que son demasiado pequeños para ser pastoreados por la almeja, evitando así la competencia. Además, L. tetraspina parece impermeable a la depredación por el almeja o (casi) cualquier otra cosa. El crecimiento de la red alimenticia microbiana y la invasión de L. tetraspina son el resultado de un camino alternativo que aún no ha sido explotado para el flujo de energía en la red alimenticia, facilitado por C. amurensis. Los patrones subsiguientes de invasión pueden reflejar un patrón similar.
Especies introducidas[editar]
Las introducciones a las especies han aumentado desde el siglo XIX en función del aumento del comercio. Las introducciones incluyen numerosos taxones, incluyendo copépodos, camarones, anfípodos, bivalvos, peces y plantas arraigadas y flotantes. Muchas especies pelágicas se han introducido más recientemente a través de las descargas de agua de grandes barcos directamente en el estuario.[66] Como resultado, muchas de estas especies introducidas se originan en estuarios alrededor de la orilla del Pacífico, como los copépodos como P. forbesi y L. tetraspina. La almeja del río Amur se origina en Asia y ha creado cambios significativos y drásticos en la ecología de la ZBS, principalmente mediante el desvío de alimentos pelágicos.[67]
Las species han sido introducidas por medio de barcos que se llevan entre las regiones.[66] Esta es la fuente probable de varias plantas de baja salinidad como Egeria densa y jacinto de agua (Eichhornia crassipes). Estas plantas han creado algunos cambios en el Delta interrumpiendo el flujo de agua, protegiendo el fitoplancton y proporcionando hábitat para peces como el Morone saxatilis, el cual se introdujo a finales de 1800 en la Bahía de Chesapeake.[50][66] El mejillón quagga de agua dulce, proviene de Europa y se espera que sea introducido por los pescadores dentro de dos a diez años, a pesar de las medidas de precaución.[68] Además, la edad joven y el entorno aislado del estuario de San Francisco han dado como resultado qu tengan éxito los invasores debido a la falta de biodiversidad.[52]
Invasiones futuras[editar]
La red alimenticia moderna se deriva de una serie de invasiones y sustituciones tróficas.
Se espera que este proceso continúe, a medida que los nuevos organismos lleguen a través de introducciones accidentales o intencionales. Lo que no está claro es hasta qué punto las introducciones previas encuentrar su camino para futuras invasiones. Esto puede ocurrir en distintas formas:
- Un invasor puede proporcionar un recurso que no se utiliza en el nuevo sistema hasta que se introduzca un nuevo depredador (L. tetraspina y el ciclo microbiano, como se ha explicado en las secciones anteriores).
- Estos nvasores pueden facilitar otros nuevos, ya que alteran el hábitat y lo hacen adecuado para futuras invasiones (pólipos gelatinosos usando las conchas de almeja del río Amur).
- La competencia aparente entre residentes antiguos y nuevos puede aumentar las posibilidades de invasión y asentamiento de nuevos organismos que pueden capitalizar recursos que aún no han sido explotados (la subvención de la almeja del río Amur por las poblaciones río arriba del copepodo introducido P. forbesi, creando presión sobre los copépodos nativos).
Resúmen[editar]
La red alimenticia ZBS del estuario de San Francisco opera en dos direcciones paralelas y asimétricas. El carbono se asimila a los bentónicos y microbianos, que representan los extremos muertos energéticos. Una fracción más pequeña se entrega a niveles tróficos pelágicos más altos que pueden soportar copépodos, peces y aves. Esta redirección de la red alimenticia en estos dos lazos estrechos puede ser responsable de la disminución de los macroinvertebrados y peces en el estuario, que operan fuera de estas cadenas. La restauración del estuario a un grado muy alto de función se basa en la probabilidad de proporcionar mayores beneficios a la red pelágica sin subsidiar el bentónico.
Ecología futura[editar]
La ecología de ZBS de el estuario de San Francisco es difiícil de caracterizar porque es el resultado de una siergia compleja de los factores abióticos y bióticos. Además, continúa con un cambio rápido por las nuevas especies que se introducen y el cambio climático. Los futuros cambios ecológicos se harán a gran escala, particularmente al ritmo del aumento del nivel del mar, la inestabilidad tectónica y el deterioro de las infraestructuras causan fallas en los diques del Delta.[69] Se espera que el retroceso del flujo de agua resultante obligue a X2 a entrar a Delta, poniendo en peligro el hábitat (los pantanos de agua dulce), canalizando la ZBS y amenazando el suministro de agua del sur de California con consecuencias desconocidas e imprevisibles para el medio natural y la ecología humana del estuario más grande de la costa oeste.
Notas[editar]
- ↑ a b c d e Kimmerer 2004
- ↑ a b Conomos 1979
- ↑ Vayssieres 2006
- ↑ Jassby 2000
- ↑ Deverel 1998
- ↑ Philip 2007
- ↑ Lund 2007
- ↑ a b Kimmerer 2002
- ↑ Moyle 1992
- ↑ a b Bennett 2006
- ↑ Monismith 1996
- ↑ Burau 1998
- ↑ Schoellhamer 2001
- ↑ Orsi 1986
- ↑ a b Kimmerer 2006
- ↑ Davis, Jay (September 2006). «The Pulse of the Estuary 2006». sfei.org. San Francisco Estuary Institute. Consultado el 2 November 2016.
- ↑ Taugher 2005
- ↑ Smith 2002
- ↑ a b Dugdale 2003
- ↑ Jassby 2002
- ↑ Nichols 1986
- ↑ Kimmerer 1994
- ↑ a b Jassby and Cloern 2000
- ↑ Anderson et al. 2002
- ↑ a b Jassby et al. 2002
- ↑ Dugdale et al. 2003
- ↑ Cloern 1987
- ↑ Cole and Cloern 1987
- ↑ Ball and Arthur 1979
- ↑ Lehman and Waller 2003
- ↑ Murrell et al. 1999
- ↑ Murrell and Hollibaugh 2000
- ↑ Jassby et al. 1993
- ↑ Hollibaugh and Wong 1996
- ↑ a b Bouley 2006
- ↑ Rollwagen-Bollens and Penry 2003
- ↑ Rollwagen-Bollens et al. 2006
- ↑ Modlin 1997
- ↑ Kimmerer 1998
- ↑ Lee 1999
- ↑ a b c d e Kimmerer 1996
- ↑ Orsi 1991
- ↑ a b Durand2006
- ↑ Orsi 1999
- ↑ Bouley and Kimmerer 2006
- ↑ Orsi and Ohtsuka 1999
- ↑ Orsi and Knutson 1979
- ↑ Modlin and Orsi 1997
- ↑ Sitts and Knight 1979
- ↑ a b Radovich 1963
- ↑ Peterson 1997
- ↑ a b Nichols et al. 1986
- ↑ Poulton et al. 2002
- ↑ Richman and Lovvorn 2004
- ↑ Scientists race to identify goop on birds along San Francisco Bay shorelines(January 2015), Christian Science Monitor
- ↑ a b Skinner, John E. (1962). An Historical Review of the Fish and Wildlife Resources of the San Francisco Bay Area (The Mammalian Resources). California Department of Fish and Game, Water Projects Branch Report no. 1. Sacramento, California: California Department of Fish and Game.
- ↑ Suzanne Stewart and Adrian Praetzellis (November 2003), Archeological Research Issues for the Point Reyes National Seashore - Golden Gate National Recreation Area, Anthropological Studies Center, Sonoma State University, p. 335, consultado el Jan 10, 2010.
- ↑ Thompson, R. A. (1896). The Russian Settlement in California Known as Fort Ross, Founded 1812...Abandoned 1841: Why They Came and Why They Left. Santa Rosa, California: Sonoma Democrat Publishing Company. p. 7. ISBN 0-559-89342-6.
- ↑ White, Peter (1995). The Farallon Islands: Sentinels of the Golden Gate. San Francisco, California: Scottwall Associates. ISBN 0-942087-10-0.
- ↑ Tappe, Donald T. (1942). «The Status of Beavers in California». Game Bulletin No. 3 (California Department of Fish & Game).
- ↑ «Get Outside!». San Francisco Chronicle. April 1966. Consultado el 6 de marzo de 2011.
- ↑ «Blue Oak Ranch Reserve». University of California. Consultado el 6 de marzo de 2011.
- ↑ Werner and Hollibaugh 1993
- ↑ Carlton et al. 1990
- ↑ Nichols et al. 1990
- ↑ a b c Carlton 1996
- ↑ Cole 1992
- ↑ Dey 2007
- ↑ Epstein 2006
Referencias[editar]
- Anderson, D. M., P. M. Glibert, and J. M. Burkholder. 2002. Harmful Algal Blooms and Eutrophication: Nutrient Sources, Composition, and Consequences. Estuaries 25:704-726.
- Ball, M. D., and J. F. Arthur. 1979. Planktonic chlorophyll dynamics in the northern San Francisco Bay and Delta. Pages 265-286 in T. J. Conomos, editor. San Francisco Bay: The urbanized estuary. American Association for the Advancement of Science, Pacific Division, San Francisco, CA.
- Bennett, W. A. (2006). Delta Smelt Growth and Survival During the Recent Pelagic Organism Decline: What Causes Them Summer Time Blues? CALFED Science Conference. Sacramento, CA.
- Bouley P., W. J. K. (2006). "Ecology of a highly abundant, introduced cyclopoid copepod in a temperate estuary. " Marine Ecology Progress Series 324: 219-228.
- Burau, J. R. (1998). "Results from the hydrodynamic element of the 1994 entrapment zone study in Suisun Bay, Sacramento, CA. " Interagency Ecological Program for the San Francisco Bay-Delta Estuary Technical Report 56: 13-62.
- Carlton, J. T., J. K. Thompson, L. E. Schemel, and F. H. Nichols. 1990. Remarkable invasion of San Francisco Bay (California, USA) by the Asian clam Potamocorbula amurensis. 1. Introduction and dispersal. Marine Ecology Progress Series. 66:81-94.
- Carlton, J. (1996). "Biological Invasions and Cryptogenic Species. " Ecology 77(6).
- Cole, B. E., and J. E. Cloern. 1987. An empirical model for estimating phytoplankton productivity in estuaries. Marine Ecology Progress Series. 36:299-305.
- Cole, B. E., J. K. Thompson, and J. E. Cloern (1992). "Measurement of filtration rates by infaunal bivalves in a recirculating flume. " Marine Biology 113: 219-225.
- Cloern, J. E. 1987. Turbidity as a control on phytoplankton biomass and productivity in estuaries. Continental Shelf Research 7:1367-1381.
- Conomos, T. J., Ed. (1979). San Francisco Bay: The urbanized estuary. San Francisco, CA, Pacific Division, American Association for the Advancement of Science.
- Deverel, S. (1998). Subsidence mitigation in the Sacramento-San Joaquin Delta., CALFED Bay-Delta Program.
- Dey, R. (2007, January 16, 2007). "Invasive Mussel Update from Lake Mead National Recreation Area. " 100th Meridian Initiative, from http://100thmeridian. org/mead. asp.
- Dugdale, R. C., V. Hogue, A. Marchi, A. Lassiter, and F. Wilkerson. 2003. Effects of anthropogenic ammonium input and flow on primary production in the San Francisco Bay. CALFED Science Program, Sacramento, CA.
- Durand, J. (2006). Determinants of calanoid copepod recruitment failure in the San Francisco Estuary Calfed Science Program. Sacramento, CA.
- Epstein, E. (2006). Creaky levees ripe for disaster. San Francisco Chronicle. San Francisco.
- Hollibaugh, J. T., and P. S. Wong. 1996. Distribution and activity of bacterioplankton in San Francisco Bay. Pages 263-288 in J. T. Hollibaugh, editor. San Francisco Bay: The ecosystem. American Association for the Advancement of Science, San Francisco, CA.
- Jassby, A. D., J. E. Cloern, and B. E. Cole. 2002. Annual primary production: Patterns and mechanisms of change in a nutrient-rich tidal ecosystem. Limnology and Oceanography 47:698-712.
- Jassby, A. D., J. E. Cloern, and T. M. Powell. 1993. Organic carbon sources and sinks in San Francisco Bay - variability induced by river flow. Marine Ecology Progress Series. 95.
- Jassby, A. D., and J. E. Cloern. 2000. Organic matter sources and rehabilitation of the Sacramento-San Joaquin Delta (California, USA). Aquatic Conservation: Marine and Freshwater Ecosystems 10:323-352.
- Jassby, A. D., J. E. Cloern and B. E. Cole. (2002). "Annual primary production: Patterns and mechanisms of change in a nutrient-rich tidal ecosystem. " Limnology and Oceanography 47(3): 698-712.
- Kimmerer, W. J., E. Gartside, and J. J. Orsi. (1994). "Predation by an introduced clam as the likely cause of substantial declines in zooplankton of San Francisco Bay. " Mar. Ecol. Prog. Ser. 113: 81-93.
- Kimmerer, W. J., J. J. Orsi. 1996. Changes in the zooplankton of the San Francisco Bay estuary since the introduction of the clam Potamocorbula amurensis. Pages 403-425 in J. T. Hollibaugh, editor. San Francisco Bay: The Ecosystem. American Association for the Advancement of Science, San Francisco, CA.
- Kimmerer, W. J., J. R. Burau, and W. A. Bennett. (1998). "Tidally oriented vertical migration and position maintenance of zooplankton in a temperate estuary. " Limnol. Oceanogr. 43(7): 1697-1709.
- Kimmerer, W. J. (2002). "Physical, biological, and management responses to variable freshwater flow into the San Francisco Estuary. " Estuaries 25: 1275-1290.
- Kimmerer, W. (2004). "Open water process of the San Francisco Estuary: from physical forcing to biological responses. " San Francisco Estuary and Watershed Science 2(1).
- Kimmerer, W. (2006). "Response of anchovies dampens effects invasive bivalve Corbula amurensis on San Francisco Estuary foodweb. " Marine Ecology Progress Series 324: 207-218.
- Lee, C. E. (1999). "Rapid and repeated invasions of fresh water by the copepod Eurytermora affinis. " Evolution 53(5): 1423-1434.
- Lehman, P. W., and S. Waller. 2003. Microcystis blooms in the delta. IEP Newsletter 16:18-19.
- Lund, J., E. Hanak, W. Fleenor, R. Howitt, J. Mount, P. Moyle (2007). Envisioning Futures for the Sacramento-San Joaquin Delta. San Francisco, Public Policy Institute.
- Modlin, R. F., and J. J. Orsi (1997). "Acanthomysis bowmani, a new species, and A. asperali, Mysidacea newly reported from the Sacramento-San Joaquin Estuary, California (Crustacea: Mysidae). " Proceedings of the Biological Society of Washington 110(3): 439-446.
- Monismith, S. G., J. R. Burau, and M. Stacey (1996). Stratification dynamics and gravitational circulation on northern San Francisco Bay. San Francisco Bay: The ecosystem. J. T. Hollibaugh. San Francisco, CA, American Association for the Advancement of Science: 123-153.
- Moyle, P. B., B. Herbold, D. E. Stevens, and L. W. Miller. (1992). "Life history and status of delta smelt in the Sacramento-San Joaquin Estuary, California. " Trans. Am. Fish. Soc. 121: 67-77.
- Murrell, M. C., J. T. Hollibaugh, M. W. Silver, and P. S. Wong. 1999. Bacterioplankton dynamics in northern San Francisco Bay: Role of particle association and seasonal freshwater flow. Limnology and Oceanography. 44:295-308.
- Murrell, M. C., and J. T. Hollibaugh. 2000. Distribution and composition of dissolved and particulate organic carbon in northern San Francisco Bay during low flow conditions. Estuarine Coastal and Shelf Science 51:75-90.
- Nichols, F. H., J. E. Cloern, S. Luoma, and D. H. Peterson. 1986. The modification of an estuary. Science 231:567-573.
- Nichols, F. H., J. K. Thompson, and L. E. Schemel. 1990. Remarkable invasion of San Francisco Bay (California, USA) by the Asian clam Potamocorbula amurensis. 2. Displacement of a former community. Marine Ecology Progress Series. 66:95-101.
- Orsi, J. J., and A. C. Knutson. 1979. The role of mysid shrimp in the Sacramento-San Joaquin Estuary and factors affecting their abundance and distribution. Pages 401-408 in T. J. Conomos, editor. San Francisco Bay: the urbanized estuary. American Association for the Advancement of Science, Pacific Division, San Francisco.
- Orsi, J. J., and W. L. Mecum. (1986). "Zooplankton distribution and abundance in the Sacramento-San Joaquin Delta in relation to certain environmental factors. " Estuaries 9(4 B): 326-339.
- Orsi, J. J., and T. C. Walter. (1991). "Pseudodiaptomus forbesi and P. marinus (Copepoda: Calanoida), the latest copepod immigrants to California's Sacramento-San Joaquin Estuary. " Bull. Plankton Soc. Japan Spec. Vol. (Proceedings of the Fourth International Conference on Copepoda): 553-562.
- Orsi, J. J., and S. Ohtsuka. (1999). "Introduction of the Asian copepods Acartiella sinensis, Tortanus dextrilobatus (Copepoda: Calanoida), and Limnoithona tetraspina (Copepoda: Cyclopoida) to the San Francisco Estuary, California, USA. " Plank. Bio. Ecol. 46: 128-131.
- Peterson, H. 1997. Clam-stuffed sturgeon. IEP Newsletter 9:19-19.
- Philip, T. (2007). A time to deliver water solutions. Sacramento Bee. Sacramento, CA.
- Poulton, V. K., J. R. Lovvorn, and J. Y. Takekawa. 2002. Clam density and scaup feeding behavior in San Pablo Bay, California. The Condor. 104:518-527.
- Radovich, J. (1963). "Effects of ocean temperature on the seaward movement of striped bass, Roccus saxatilis, on the Pacific coast. " California Department of Fish and Game 49: 191-205.
- Richman, S. E., and J. R. Lovvorn. 2004. Relative foraging value to lesser scaup ducks of native and exotic clams from San Francisco Bay. Ecological Applications 14:1217-1231.
- Rollwagen-Bollens, G. C., and D. L. Penry. 2003. Feeding dynamics of Acartia sp. in a large, temperate estuary (San Francisco Bay, CA). Marine Ecology Progress Series 257:139-158.
- Rollwagen-Bollens, G., S. Gifford, A. Slaughter, and S. M. Bollens. 2006. Protists in a Temperate Estuary: Diversity, Grazing and Consumption by Metazoans. Eos, Transactions of the American Geophysical Union, Ocean Sciences Meeting Supplement. 87:36 OS11D-05.
- Schoellhamer, D. H. (2001). Influence of salinity, bottom topography, and tides on locations of estuarine turbidity maxima in northern San Francisco Bay. Coastal and Estuarine Fine SedimentProcesses. W. H. McAnally and A. J. Mehta. Amsterdam, Netherlands, Elsevier: 343-356.
- Sitts R. M., A. W. Knight. 1979. Predation by the estuarine shrimps Crangon franciscorum Stimpson and Palaemon macrodactylus Rathbun. Biological Bulletin 156:356-368.
- Smith, S. V., and J. T. Hollibaugh (2002). "Water, salt, and nutrient exchanges in the San Francisco Bay. " Interagency Ecological Program for the San Francisco Bay-Delta Estuary TechnicalReport 66.
- Taugher, Mike (2005). Environmental sirens in Delta are screaming. Contra Costa Times.
- Trott, J. S. S., Warren J. Ferguson, and Andrew J. Kleinfeld, (2006). Central Delta Water Agency v. Bureau of Reclamation. United States Court of Appeals for the Ninth Circuit. San Francisco, CA.
- Vayssieres, M. P. (2006). Trends in the benthos of the upper San Francisco Esutary. CALFED Science Conference. Sacramento, CA.
- Werner, I., and J. T. Hollibaugh. 1993. Potamocorbula amurensis (Mollusca, Pelecyopoda): Comparison of clearance rates and assimilation efficiencies for phytoplankton and bacterioplankton. Limnology and Oceanography 38:949-964.
