Ullmann condensación
La Ullmann condensación o Síntesis de éter de Ullmann es una variación de la reacción de Ullmann, en el que un fenol está acoplado a un arilo haluro para crear un éter de diarilo en presencia de un cobre compuesto, nombrado por el químico alemán Fritz Ullmann (1875–1939).[1] La correspondiente anilina o aril amida reacción a veces se llama reacción Goldberg, el nombre de Irma Goldberg.[2]
Un ejemplo es la síntesis de fenil éter p-nitrofenil[3]

Un polvo activo de cobre se requiere para esta reacción que se puede preparar por la reducción de sulfato de cobre por zinc metal en el agua caliente y causa la precipitación de cobre elemental.
La reacción requiere a menudo un alto punto de ebullición de disolventes polares tales como N-metilpirrolidona, nitrobenceno o dimetilformamida y las altas temperaturas (a menudo en exceso de 210 °C) con estequiométricas cantidades de cobre. El haluro de arilo se activa por grupos aceptores de electrones o lleva un ácido carboxílico en el grupo aromático en posición orto.[4] El campo de investigación fue revitalizado con la introducción de las reacciones catalíticas de cobre[5] en 2001-2003 usando hasta 0,1 equivalentes de cobre yoduro, base y una diamina.
Reacción Goldberg[editar]
Un ejemplo de una reacción de Goldberg es la síntesis de ácido fenámico, un intermedio de acridona a través de la reacción de Goldberg:[6]

Una reacción de aminación aromática de tipo Ullmann entre un yoduro de arilo y una amina de arilo como socios de acoplamiento ha sido publicado.[7] El catalizador utilizado se forma a partir de cobre (I) yoduro y fenantrolina. Como esta reacción se desarrolla bien con un yoduro de arilo rico en electrones es una valiosa alternativa a la reacción de aminación de Buchwald-Hartwig, lo que da mejores rendimientos con haluros de arilo pobre en electrones. El ámbito de aplicación se extiende a amidas[8][9][10] por ejemplo, en la síntesis de esta Campamentos ciclación precursor:[11]

Reacción Hurtley[editar]
El nucleófilo puede ser también de carbono como en un carbanión en la reacción Hurtley.[12]
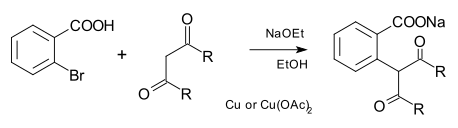
En el ámbito original del areno fue ácido 2-bromobenzoico, el carbono nucleófilo un éster malónico y otros compuestos dicarbonilo y la base de etóxido de sodio.
Referencias[editar]
- ↑ Fritz Ullmann, Paul Sponagel (1905). «Ueber die Phenylirung von Phenolen». Berichte der deutschen chemischen Gesellschaft 38 (2): 2211-2212. doi:10.1002/cber.190503802176.
- ↑ Irma Goldberg (1906). «Ueber Phenylirungen bei Gegenwart von Kupfer als Katalysator». Berichte der deutschen chemischen Gesellschaft 39 (2): 1691-1692. doi:10.1002/cber.19060390298.
- ↑ Ray Q. Brewster and Theodore Groening, "Ether, p-nitrophenyl phenyl", Organic Syntheses, Coll. Vol. 2, p.445 Online article Archivado el 19 de octubre de 2012 en Wayback Machine.
- ↑ Minireview Catalytic CC, CN, and CO Ullmann-Type Coupling Reactions Florian Monnier, Marc Taillefer Angewandte Chemie International Edition Volume 48 Issue 38, pp. 6954–6971, 2009 doi 10.1002/anie.200804497
- ↑ Copper-Catalyzed Formation of Carbon–Heteroatom and Carbon–Carbon Bonds, Buchwals, Stephen, L. et al. 2003 WO02/085838 Link (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ C. F. H. Allen and G. H. W. McKee (1943). "Acridone". Org. Synth.; Coll. Vol. 2: 15.
- ↑ H.B. Goodbrand, Nan-Xing Hu (1999). «Ligand-Accelerated Catalysis of the Ullmann Condensation: Application to Hole Conducting Triarylamines». Journal of Organic Chemistry 64 (2): 670-674. doi:10.1021/jo981804o.
- ↑ Klapars, A.; Antilla, J. C.; Huang, X.; Buchwald, S. L. (2001). «A General and Efficient Copper Catalyst for the Amidation of Aryl Halides and the N-Arylation of Nitrogen Heterocycles». J. Am. Chem. Soc. (Communication) 123 (31): 7727-7729. doi:10.1021/ja016226z.
- ↑ Klapars, A.; Huang, X.; Buchwald, S. L. (2002). «A General and Efficient Copper Catalyst for the Amidation of Aryl Halides». J. Am. Chem. Soc. (Article) 124 (25): 7421-7428. doi:10.1021/ja0260465.
- ↑ Strieter, E. R.; Blackmond, D. G.; Buchwald, S. L. (2005). «The Role of Chelating Diamine Ligands in the Goldberg Reaction: A Kinetic Study on the Copper-Catalyzed Amidation of Aryl Iodides». J. Am. Chem. Soc. (Communication) 127 (12): 4120-4121. PMID 15783164. doi:10.1021/ja050120c.
- ↑ Jones, C. P.; Anderson, K. W.; Buchwald, S. L. (2007). «Sequential Cu-Catalyzed Amidation-Base-Mediated Camps Cyclization: A Two-Step Synthesis of 2-Aryl-4-quinolones from o-Halophenones». J. Org. Chem. 72 (21): 7968-7973. PMID 17850097. doi:10.1021/jo701384n.
- ↑ CCXLIV.—Replacement of halogen in orthobromo-benzoic acid William Robert Hardy Hurtley, J. Chem. Soc., 1929, 1870 doi 10.1039/JR9290001870
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Ullmann condensation» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
