Síntesis de quinolinas de Friedländer
Apariencia
La Síntesis de quinolinas de Friedländer es un método de síntesis orgánica que consiste en la reacción de 2-aminobenzaldehídos[1] con cetonas para obtener derivados de quinolina.[2][3] Se le nombra en honor del químico alemán Paul Friedländer (1857-1923).

Esta reacción ha sido catalizada por ácido trifluoroacético,[4] ácido toluenosulfónico,[5] yodo,[6] y ácidos de Lewis.[7]
Varios estudios se han publicado al respecto.[8][9][10][11]
Mecanismo
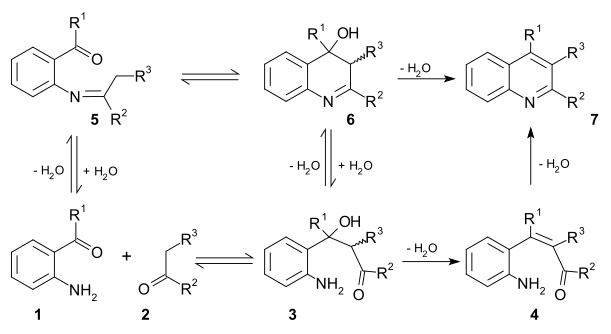
Existen dos mecanismos de reacción viables para esta reacción.
- En el primer mecanismo, un compuesto 2-aminocarbonílico sustituido 1 y otro compuesto carbonílico 2 reaccionan en un paso limitante de para dar el aducto de condensación aldólica 3. Este intermediario se deshidrata en una reacción de eliminación para dar el compuesto carbonílico α,β-insaturado 4 y se vuelve a deshidratar para formar una imina y después la quinolina 7.
- En el segundo mecanismo, el primer paso es la formación de base de Schiff con 5 seguido por la reacción aldólica a 6 y la eliminación para obtener el compuesto 7.[12]
Referencias
- ↑ Organic Syntheses, Coll. Vol. 3, p.56 (1955); Vol. 28, p.11 (1948). (Article)
- ↑ Friedländer, P. Ber. 1882, 15, 2572.
- ↑ Friedländer, P.; Gohring, C. F. Ber. 1883, 16, 1833.
- ↑ Shaabani, A.; Soleimani, E.; Badri, Z. Synth. Commun. 2007, 37, 629-635. (doi 10.1080/00397910601055230)
- ↑ Jia, C.-S.; Zhang, Z.; Tu, S.-J.; Wang, G.-W. Org. Biomol. Chem. 2006, 4, 104-110.
- ↑ Wu, J.; Xia, H.-G.; Gao, K. Org. Biomol. Chem. 2006, 4, 126-129.
- ↑ Varala, R.; Enugala, R.; Adapa, S. R. Synthesis 2006, 3825-3830.
- ↑ Cheng, C.-C.; Yan, S.-J. Org. React. 1982, 28, 37. (doi: 10.1002/0471264180.or028.02)
- ↑ Manske, R. H. Chem. Rev. 1942, 30, 113. (Review)
- ↑ Bergstrom, F. W. Chem. Rev. 1944, 35, 77. (Review)
- ↑ Cheng, C. C.; Yan, S. J. Org. React. 1982, 28, 37. (Review)
- ↑ Recent Advances in the Friedlander Reaction Jose Marco-Contelles, Elena Perez-Mayoral,Abdelouahid Samadi, Marıa do Carmo Carreiras, and Elena Soriano Chem. Rev. 2009 doi 10.1021/cr800482c
Véase también
- Síntesis de quinolinas de Combes
- Síntesis de quinolinas de Doebner
- Síntesis de quinolinas de Gould-Jacobs
- Síntesis de quinolinas de Knorr
- Síntesis de quinolinas de Riehm
- Síntesis de quinolinas de Skraup
- Síntesis de quinolinas de Pfitzinger
- Síntesis de quinolinas de Conrad-Limpach
- Síntesis de quinolinas de Camps
- Síntesis de quinolinas de Doebner-Miller
- Síntesis de quinolinas de Niementowski