Sarcómero
Z = línea-Z.
M = línea M
Thin filament = Filamento fino (en azul).
Thick filament = Filamento grueso (en rojo).
El sarcómero o sarcómera (gr. σάρξ sarks 'carne, cuerpo', μέρος meros 'parte') es la unidad anatómica y funcional de la miofibrilla de los músculos estriados . Un sarcómero (SRM) es una estructura altamente ordenada, de las más grandes conocidas en biología. Cada SRM contiene grandes polímeros de proteínas llamados miofilamentos, que están compuestos principalmente por las proteínas actina, miosina y titina. El deslizamiento entre los dos tipos de miofilamentos: los finos y los gruesos, permite el acortamiento del SRM y de la miofibrilla, con generación de fuerza y soporte de carga.
Las alteraciones de algunas de las moléculas de los SRM, desencadenan enfermedades denominadas miopatías.
Características
[editar]Los sarcómeros (SCM) son dispositivos de generación de fuerza y soporte de carga, los cuales mediante repetición conforman una miofibrilla.[1] Un número promedio de miofibrillas altamente empaquetadas forman una fibra muscular (miocito). Las fibras musculares individuales son sincitios muy grandes, que pueden tener hasta varios centímetros de longitud.
El ensamblaje regular y repetitivo de los sarcómeros, dan al músculo estriado su apariencia rayada al ser observado con el microscopio. En los sarcómeros, los filamentos contráctiles de actina y miosina se integran en un orden paracristalino por la acción de proteínas citoesqueléticas accesorias, formando lo que a menudo se denomina el «citoesqueleto sarcomérico».[2]
Estructura
[editar]El sarcómero (SRM) es de tamaño microscópico con ~2,3–2,47 micrómetros (μm) de longitud total.[3]
Los SRM están conectados en serie mediante el disco Z y dispuestos en paralelo para formar haces de miofibrillas de aproximadamente 1 μm de diámetro.[4]
El sarcómero es un conjunto multiproteico (supra-macromolecular) altamente ordenado, de los más grandes conocidos en biología. Los SRCM se definen por sus límites densos en proteínas (discos Z), y están compuestos principalmente de las proteínas actina, miosina y titina.[3]
Microaquitectura
[editar]Con el microscopio óptico y tinciones histológicas, la arquitectura del sarcómero (SRM) muestra la alternancia de bandas teñidas y bandas claras, dando el aspecto de estriaciones.
La microscopía confocal mediante la inmuno-histoquímica y la inmuno-fluorescencia permite visualizar la ubicación de una molécula proteica específica en el límite de un sarcómero (disco Z) para determinar su longitud o para ubicar su centro (línea M).

Discos Z (en verde) .
Líneas M (en rojo).
Microscopía confocal. inmuno-fluorescencia.
Ultraestructura
[editar]Las imágenes de microscopía electrónica de transmisión, revelan la división de los sarcómeros (SRM) en diferentes regiones con densidades electrónicas distintas por la presencia de los filamentos gruesos (de miosina) y los delgados (de actina).[5]
Barra de escala= 1 micrómetro (μm).
El sarcómero aparece con varias regiones densas diferentes, cada área resulta compuesta de muchos miofilamentos conectados con las áreas periféricas (los discos Z), o dentro de la región central (la banda M), que divide en dos mitades especulares la estructura sarcomérica.[5]


Thick filament= Filamento grueso (en azul). Tomografía crioelectrónica. B= Reconstrucción 3D.
Más allá del disco Z o línea Z, que limita cada sarcómero, se encuentra la banda I, que rodea la línea Z, compuesta solamente por filamentos delgados. Después de la banda I se encuentra la banda A que contiene filamentos gruesos y delgados. Dentro de la banda A, se encuentra la zona H compuesta de filamentos gruesos y dentro de la zona H, se encuentra la línea M que está en el medio del sarcómero.[5]
El sarcómero (SRM) se puede dividir a lo largo de su eje en diferentes zonas en función de su ultraestructura:
- el disco Z que limita el sarcómero en sus extremos, anclando los extremos barbados (+) de los filamentos de actina,
- la banda I (isotrópica) donde solo están presentes filamentos de actina (delgados),
- la banda A (anisótropa) que contiene filamentos superpuestos de actina y miosina (gruesos),
- la banda M en el centro, donde solo están presentes filamentos de miosina y entrecruzados. La banda M es una zona desnuda desprovista de «cabezas de miosina» donde se entrelazan las «colas de miosina» pertenecientes a semisarcómeros yuxtapuestos.[6]
El disco Z está formado por los extremos de filamentos delgados antiparalelos de sarcómeros adyacentes.[1]
En la banda I del sarcómero pueden distinguirse los filamentos de actina (filamento fino) que nacen de los discos de Z, donde existe la alfa actinina, que es la proteína que une la actina y la titina. Esta última es una proteína elástica (la más grande del organismo), y posee dos funciones:
- Mantiene a la miosina en su posición.
- Debido a que tiene una parte elástica, actúa como resorte recuperando la longitud de la miofibrilla después de la contracción muscular.
En la banda A del sarcómero se encuentran los filamentos de miosina (filamento grueso), responsables de la contracción muscular.
Miofilamentos
[editar]Cada sarcómero contiene estructuras constituidas por grandes polímeros de proteínas llamados miofilamentos de actina y de miosina. Estos miofilamentos se ensamblan entre sí, con unos 1500 filamentos gruesos de miosina y 3000 filamentos finos de actina por cada miofibrilla.[7]


Thick filament= Filamento grueso (miosina) derecha.
Thin filament = Filamento fino en verde (actina).
Los filamentos de actina de longitudes casi idénticas se disponen en formaciones entrelazadas con filamentos de miosina de longitud idéntica.[2]
Los sarcómeros contienen proteínas estructurales que son específicas y únicas en sus características funcionales y arquitectónicas.
Los sarcómeros contienen numerosas proteínas adicionales que se localizan en dominios distintos que son importantes para su función. Estas forman una red intrincada con otras proteínas α-actinin, titin, nebulin y myotilin.
La función del sarcómero depende tanto de la cantidad como de la localización de sus muchas proteínas.[3]
Los filamentos gruesos (de ~16 nanómetros (nm) de diámetro) son estructuras bipolares que contienen miosina II, MyBP-C (myosin binding protein-C) y titina, así como varias otras proteínas cerca de la zona desnuda, que marca el eje de simetría del filamento grueso y el centro del sarcómero.[8]
Los filamentos finos (de ~10 nm de diámetro) están compuestos fundamentalmente por actina, tropomiosina, el complejo troponina con sus tres subunidades, tropomodulina y nebulina.[9]
El filamento helicoidal de la Actina F contiene también una molécula de tropomiosina,
Los sarcómeros se definen por sus límites densos en proteínas, conocidos como discos Z.
La nanoarquitectura del SRCM depende fundamentalmente de la gran proteína titina, que se extiende desde el disco Z sarcomérico hasta la banda M y, por tanto, une de forma estable los filamentos de actina y miosina.[10]
Nano arquitectura
[editar]- La molécula de titina
tiene más de 1 micrómetro de largo y se extiende in situ por la mitad del sarcómero, con el extremo N en la línea Z y el extremo C en la línea M.[11]
- La molécula de nebulina
Las dos proteínas filamentosas gigantes, titina y la nebulina de un solo polipéptido, están unidas in situ a lo largo de los filamentos gruesos (titina) y delgados (nebulina), respectivamente, con una coincidencia casi perfecta en las respectivas longitudes y periodicidades estructurales. Sin embargo, la evidencia aún cuestiona la posibilidad de que las proteínas funcionen como plantillas, o andamios.[12]
Citoesqueleto sarcomérico
[editar]Los filamentos intermedios sirven como andamiaje que conecta el sarcómero con las mitocondrias o el núcleo, para mantener la integridad celular y para contribuir a la transducción mecánica. El sarcómero está unido a la membrana (sarcolema) por otro conjunto citoesquelético: el costámero.[13]
En el interior de cada célula muscular hay numerosos conjuntos citoesqueléticos.
El disco Z sirve como un sitio de anclaje para el extremo N de los sistemas de filamentos de titina y nebulina/nebuleta, lo que lo hace indispensable para la transmisión de la fuerza contráctil. La α-actinina fue la primer proteína importante de este disco.[13]
- alfa actinina
es un miembro de la superfamilia de la espectrina y se describió originalmente como un reticulador de filamentos de actina. Interactúan con ACTA2: ALP (proteína LIM asociada a actinina), MLP (proteína LIM muscular), extremo N de la titina, miotilina, CapZ, cypher/oracle/ZASP, FATZ (proteína de unión a la filamina, α-actinina y teletonina en el disco Z), miopaladina y miopodina.
- filamina c
también se unen y forman enlaces cruzados con actina, es una de las principales proteínas que sirve como enlace entre el costámero y el disco Z.
- miotilina
dímeros de miotilina reticulan y estabilizan los filamentos de actina en el disco Z,
La mayoría de las proteínas del citoesqueleto sarcomérico están organizadas por interacciones específicas con la proteína gigante, la titina de ∼3 MDa.
La titina ensambla el citoesqueleto sarcomérico, estas numerosas interacciones también coordinan los dominios de señalización y las enzimas metabólicas.
La nebulina y la titina forman filamentos largos compuestos de polipéptidos individuales y, como tal, el citoesqueleto sarcomérico es una especialización única del sistema de actomiosina.[2]
Tipos de bandas y zonas
[editar]- Banda A: Banda compuesta por los gruesos de 140 Å de miosina y finos de actina. En su interior podemos encontrar además:
- Zona H: Zona donde solo hay filamentos gruesos -de miosina- visible, es decir, corresponde al sector de la banda A donde no existen filamentos finos -de actina-.
- Línea M: Zona donde la miosina se encuentra unida a la miosina adyacente, en la cual se contraen músculos internos cardiovasculares.
- Banda I: Banda compuesta por los filamentos finos de 80 Å de actina.
- Discos Z: Sector donde se encuentran unidas las actinas adyacentes y se mantiene la continuidad con el sarcómero subsiguiente. En ellas se encuentra la proteína CapZ.
Fisiología
[editar]Millones de sarcómeros (SRM) que actúan al unísono a lo largo de una miofibrilla, en distancias de milímetros hasta centímetros amplifican la fuerza y el movimiento. La disposición completamente regular, paralela y repetitiva de actina y miosina permite que la fuerza y el movimiento se generen solamente en la dirección del eje del filamento.[2]

El citoesqueleto sarcomérico está conformada por proteínas citoesqueléticas accesorias, que proporcionan estabilidad mecánica, elasticidad, organización espacial y capacidad de comunicación de largo alcance.
- A nivel microscópico,
los cambios en la longitud de las células musculares están respaldados por filamentos contráctiles formados por múltiples repeticiones de una unidad básica, conocida como sarcómero.
La capacidad del sarcómero de acortarse y expandirse a voluntad está dada por tres tipos de proteínas: dos tipos de filamentos que pueden deslizarse uno sobre el otro (miosina y actina); y una molécula con forma de resorte conocida como titina, que asegura que la unidad no se deshaga al conectar mecánicamente la miosina y la actina.[10]
Durante la contracción del músculo desaparece la Zona H y se comprime la Banda I.
Función
[editar]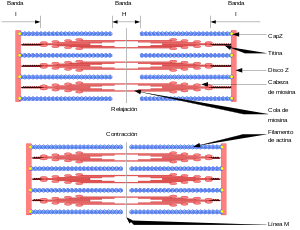
El deslizamiento de los miofilamentos finos de actina sobre los miofilamentos de gruesos de miosina dentro de cada sarcómero (SRM), producen la contracción de la miofibrilla y por extensión la contracción del músculo. La función del SRM depende tanto de la cantidad como de la localización de sus muchas proteínas.[3]
Un SRM produce fuerza a través de la interacción entre actina y miosina. La fuerza isométrica máxima que pueden generar los sarcómeros, depende de la cantidad de superposición entre los miofilamentos gruesos y finos.[14]
Véase también
[editar]Referencias
[editar]- ↑ a b Wang Z.; Grange M.; Wagner T.; Kho A.I; Gautel M.; Raunser S. (2021). «The molecular basis for sarcomere organization in vertebrate skeletal muscle.». Cell (en inglés) 184 (8): 2135-2150. PMC 8054911. PMID 33765442. doi:10.1016/j.cell.2021.02.047. Consultado el 20 de agosto de 2024.
- ↑ a b c d Matías Gautel, Kristina Djinović-Carugo (2016). «The sarcomeric cytoskeleton: from molecules to motion». Journal of Experimental Biology 219 (2): 135-145. Consultado el 21 de agosto de 2024.
- ↑ a b c d Douglas C.M.; Bird J.E.; Kopinke D.; Esser K.A. (2024). «An optimized approach to study nanoscale sarcomere structure utilizing super-resolution microscopy with nanobodies.». PLoS ONE (Public Library of Science) 19 (4): e0300348. doi:10.1371/journal.pone.0300348. Consultado el 22 de agosto de 2024.
- ↑ Claudia Crocini; Michael Gotthardt (2021 Oct;). «Cardiac sarcomere mechanics in health and disease». Biophys Rev. (REVISIÓN) (en inglés) 13 (5): 637-652. PMC 8553709. PMID 34745372. doi:10.1007/s12551-021-00840-7. Consultado el 25 de agosto de 2024.
- ↑ a b c Federico Boschi (2023). «How to estimate the sarcomere size based on oblique sections of skeletal muscle». J Anat. (en inglés) 243 (4): 648-657. PMC 10485579. PMID 37243921. doi:10.1111/joa.13892. Consultado el 22 de agosto de 2024.OA
- ↑ Davide Tamborrini, Zhexin Wang, Thorsten Wagner, Sebastian Tacke, Markus Stabrin, Michael Grange, Ay Lin Kho, Martin Rees, Pauline Bennett, Mathias Gautel, Stefan Raunser (2023). «Structure of the native myosin filament in the relaxed cardiac sarcomere». Nature (en inglés) 623 (7988): 863-871. PMC 10665186. PMID 37914933. doi:10.1038/s41586-023-06690-5. Consultado el 21 de agosto de 2024.OA
- ↑ «Organización del músculo esquelético: las fibras». Elsevier Connect. 2019. Consultado el 23 de febrero de 2020. «de Guyton y Hall, Tratado de fisiología médica, 13 ed. 2016».
- ↑ Kenneth A. Taylor (2023 Sep;). «John Squire and the Myosin Thick Filament Structure in Muscle». J Muscle Res Cell Motil. (en inglés) 44 (3): 143-152. PMC 10686309. PMID 37099254. doi:10.1007/s10974-023-09646-4. Consultado el 22 de agosto de 2024. Parámetro desconocido
|NIHMS=ignorado (ayuda) - ↑ Gabriel Nasri Marzuca-Nassr; Kaio Fernando Vitzel; Eladio Mancilla-Solorza; José Luis Márquez (2018). «Sarcomere Structure: The Importance of Desmin Protein in Muscle Atrophy» (PDF). Int. J. Morphol. (en inglés) (SciELO) 36 (2): 576-583. Consultado el 4 de septiembre de 2024.
- ↑ a b Florian Schueder, Pierre Mangeol, Eunice HoYee Chan, Renate Rees, Jürgen Schünemann, Ralf Jungmann, Dirk Görlich, Frank Schnorrer (2023). «Nanobodies combined with DNA-PAINT super-resolution reveal a staggered titin nanoarchitecture in flight muscles». eLife. (en inglés) 12: e79344. PMC 9886278. PMID 36645127. doi:10.7554/eLife.79344. Consultado el 22 de agosto de 2024.
- ↑ Larissa Tskhovrebova; John Trinick (2010). «Roles of Titin in the Structure and Elasticity of the Sarcomere». J Biomed Biotechnol (en inglés) 2010: 612482 2010 Jun 21. PMC 2896707. PMID 20625501. doi:10.1155/2010/612482. Consultado el 22 de agosto de 2024.
- ↑ Larissa Tskhovrebova; John Trinick (2017). «Titin and Nebulin in Thick and Thin Filament Length Regulation». Review Subcell Biochem (en inglés) 82: 285-318. PMID 28101866. doi:10.1007/978-3-319-49674-0_10.
- ↑ a b Christine A. Henderson, Christopher G. Gomez, Stefanie M. Novak, Lei Mi-Mi, Carol C. Gregorio (2017). «Overview of the Muscle Cytoskeleton». Compr Physiol. (en inglés) 7 (3): 891-944. PMC 5890934. PMID 28640448. doi:10.1002/cphy.c160033. Consultado el 22 de agosto de 2024. Parámetro desconocido
|NIHMS=ignorado (ayuda) - ↑ Eng Kuan Moo; Walter Herzog (2018). Sci Rep. (en inglés) 8: 15235. PMC 6189036. PMID 30323321. doi:10.1038/s41598-018-33658-7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6189036/#CR21
|url=sin título (ayuda). Consultado el 1 de setiembre de 2024.
Bibliografía
[editar]- Zhexin Wang, Michael Grange, Thorsten Wagner, Ay Lin Kho, Mathias Gautel, Stefan Raunser (2021). «The molecular basis for sarcomere organization in vertebrate skeletal muscle». Cell (en inglés) 184 (8): 2135-2150. PMC 8054911. PMID 33765442. doi:10.1016/j.cell.2021.02.047. Consultado el 21 de agosto de 2024.BY
- Wang Z.; Grange M.; Pospich S.; Wagner T.; Kho AL.; Gautel M.; Raunser S. (2022). «Structures from intact myofibrils reveal mechanism of thin filament regulation through nebulin.». Science (en inglés) 375 (6582): eabn1934. Consultado el 22 de agosto de 2024.OA
- Davide Tamborrini, Zhexin Wang, Thorsten Wagner, Sebastian Tacke, Markus Stabrin, Michael Grange, Ay Lin Kho, Martin Rees, Pauline Bennett, Mathias Gautel, Stefan Raunser (2023). «Structure of the native myosin filament in the relaxed cardiac sarcomere». Nature (en inglés) 623 (7988): 863-871. PMC 10665186. PMID 37914933. doi:10.1038/s41586-023-06690-5. Consultado el 21 de agosto de 2024.OA
- Douglas CM.; Bird JE.; Kopinke D.; Esser KA. (2024). «An optimized approach to study nanoscale sarcomere structure utilizing super-resolution microscopy with nanobodies.». PLoS ONE (en inglés) (Public Library of Science) 19 (4): e0300348. doi:10.1371/journal.pone.0300348. Consultado el 22 de agosto de 2024.BY
- Tskhovrebova L,; Trinick J. (2012). «Making Muscle Elastic: The Structural Basis of Myomesin Stretching.». PLoS Biology (en inglés) (Public Library of Science) 10 (2): e1001264. doi:10.1371/journal.pbio.1001264. BY
- Nikos Pinotsis, Spyros D. Chatziefthimiou, Felix Berkemeier, Fabienne Beuron, Irene M. Mavridis, Petr V. Konarev, Dmitri I. Svergun, Edward Morris, Matthias Rief, Matthias Wilmanns, Pinotsis N, Chatziefthimiou SD, Berkemeier F, Beuron F, Mavridis IM, Konarev PV, (2012). «Superhelical Architecture of the Myosin Filament-Linking Protein Myomesin with Unusual Elastic Properties.». PLoS Biology (en inglés) (Public Library of Science) 10 (2): e1001261. doi:10.1371/journal.pbio.1001261. BY
- Guyton, Arthur; Hall, John (2016). «Capítulo 6: Contracción del músculo esquelético». Tratado de Fisiología Médica (13 edición). Barcelona, España: Elsevier. pp. 75-80. ISBN 978-84-9113-025-3.OA
- Florian Fäßler; Manjunath G. Javoor; Florian KM Schur (2023). «Deciphering the molecular mechanisms of actin cytoskeleton regulation in cell migration using cryo-EM». Biochem Soc Trans 51 (1): 87-99.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Sarcómero.
Wikimedia Commons alberga una categoría multimedia sobre Sarcómero.






