Rucaparib
| Rucaparib | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
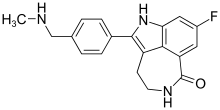
| 8-Fluoro-2-{4-[(methylamino)methyl]phenyl}-1,3,4,5-tetrahydro-6H-azepino[5,4,3-cd]indol-6-one | ||
| Identificadores | ||
| Número CAS | 283173-50-2 | |
| PubChem | 9931954 | |
| DrugBank | DB12332 | |
| Datos químicos | ||
| Fórmula | C19H18N3FO | |
| Farmacocinética | ||
| Vida media | 17-19 horas | |
| Datos clínicos | ||
| Nombre comercial | Rubraca | |
| Estado legal | Necesita prescripción médica | |
| Vías de adm. | Oral | |
Rucaparib es un medicamento indicado para el tratamiento del cáncer de ovario, cáncer de trompa de Falopio y cáncer primario de peritoneo. Pertenece al grupo de fármacos denominados inhibidores de PARP. Su uso fue aprobado por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) el 6 de abril de 2018 y por la Agencia Europea del Medicamento el 24 de enero de 2019. Se vende con el nombre comercial de Rubraca. Se administra por vía oral.[1] [2] [3] Tiene un costo de 4 900 euros por sesenta comprimidos.[4]
Mecanismo de acción
Actúa como inhibidor de las enzimas PARP (poli ADP ribosa polimerasa), impidiendo la reparación del ADN y provocando la apoptosis y muerte celular, sobre todo en aquellas células que habían sido dañadas previamente.[3]
Indicaciones
Esta indicado en el tratamiento de pacientes de cáncer de ovario, cáncer de trompa de Falopio o cáncer primario de peritoneo. Solo en pacientes tratados previamente con quimioterapia de cisplatino que hayan sufrido recaidas.
Véase también
Referencias
- ↑ Bankhead, C (19 de diciembre de 2016). «PARP Inhibitor Gets FDA Nod for Ovarian Cancer». MedPage Today, LLC. Consultado el 20 de diciembre de 2016.
- ↑ Rucaparib. European Medicines Agency. Consultado el 1 de octubre de 2019.
- ↑ a b Rucaparib. Sociedad Española de Oncología Médica. Consultado el 1 de octubre de 2019.
- ↑ «Rubraca (rucaparib)». Consultado el 1 de octubre de 2019.
