Peryodato de potasio
| Peryodato de potasio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Peryodato de potasio | ||
| General | ||
| Otros nombres | metaperyodato de potasio | |
| Fórmula estructural |
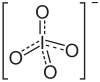 | |
| Fórmula molecular | KIO4 | |
| Identificadores | ||
| Número CAS | 7790-21-8[1] | |
| ChemSpider | 128877 | |
| PubChem | 516896 | |
| Propiedades físicas | ||
| Apariencia | Polvo blanco | |
| Densidad | 3618 kg/m³; 3,618 g/cm³ | |
| Masa molar | 230 g/mol | |
| Punto de fusión | 855 K (582 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua |
0.42 g/100 mL (20 °C) 4.4 g/100 mL (80 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
2
2
OX
| |
| Frases R | R8 R36/37/38 | |
| Frases S | S17 S26 S37 | |
| Riesgos | ||
| Ingestión | Puede ser nocivo. Enjuagar la boca con agua, atención médica. | |
| Inhalación | Irritación. Dar aire fresco, respiración artificial si es necesario, atención médica. | |
| Piel | Irritación. Lavar con jabón y abundante agua, atención médica. | |
| Ojos | Irritación. Enjuagar cuidadosamente con abundante agua por al menos 15 minutos, atención médica. | |
| Compuestos relacionados | ||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El peryodato de potasio es una sal de potasio, siendo su fórmula KIO4. Es levemente soluble en agua (una de las sales de potasio menos solubles, debido al anión grande), dando lugar a una disolución que es ligeramente alcalina. La baja solubilidad del KIO4 lo hace útil para la determinación del potasio.[2] Al calentarse, especialmente con óxido de manganeso (IV) como catalizador, se descompone para formar yodato de potasio, KIO3, liberando oxígeno gaseoso.
Síntesis
Es posible preparar peryodato de potasio en el laboratorio por la oxidación de yodato de potasio con persulfato de potasio, K2S2O8, en una solución alcalina, por ejemplo una disolución de hidróxido de potasio:
- IO3- + S2O82- + 2 OH- → IO4- + 2 SO42- + H2O
La reacción se realiza con la disolución en ebullición. Después de eso, la sal es neutralizada añadiendo ácido nítrico, precipitando, añadiendo agua fría y filtrando.
Otra forma consiste en añadir cloro Cl2 a una disolución básica de yodato de potasio:[3][4]
- KIO3 + 2 KOH + Cl2 → KIO4 + 2 KCl + H2O
Propiedades
El peryodato de potasio es un poderoso oxidante. Así, una disolución de yoduro de potasio en contacto con peryodato de potasio se oxidará en diyodo o las sales de manganeso (II) en permanganatos:[5]
- KIO4 + 2 KI + H2O → KIO3 + I2 + 2 KOH
Sus cristales son isomorfos con los del perclorato de potasio, KClO4. Una vez disueltos en una disolución de hidróxido de potasio, es posible recuperar el peryodato de potasio mediante la adición de ácido nítrico:[5][6]
- 2 KIO4 + 2 KOH → K4I2O9 + H2O
- K4I2O9 + 2 HNO3 → 2 KIO4 + 2 KNO3 + H2O
El ortoperyodato de potasio K2H3IO6 que puede obtenerse por la oxidación del yodato de potasio con hipoclorito de sodio, NaClO,[5] se descompone en agua a 100 °C con peryodato de potasio como intermediario:[7]
- 2 K2H3IO6 → K4I2O9 + 3 H2O a 100 °C
En las soluciones acuosas de peryodato de potasio se producen los siguientes equilibrios:
- [H3IO6]2- + H+ [IO4]- + 2 H2O
- [H3IO6]2- 2 [HIO5]2- + 2 H2O
- 2 [HIO5]2- [H2I2O10]4- [I2O9]4- + H2O
Referencias
- ↑ Número CAS
- ↑ Willard, Hobart H.; Boyle, Albert J. (1941). «Determination and Separation of Potassium as Periodate». Ind. Eng. Chem. Anal. Ed. 13 (3): 137-139.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 325.
- ↑ C. Rammelsberg: "Ueber die Ueberjodsäure und ihre Salze" in Ber. d. dt. chem. Ges. 1868, A1, S. 70ff.
- ↑ a b c C. E. Housecroft, A. G. Sharpe: "Inorganic chemistry", Verlag Pearson Education, 2005, ISBN 9780130399137. S. 487
- ↑ B. Brehler, H. Jacobi, H. Siebert: "Kristallstruktur und Schwingungsspektrum von K4J2O9" in Zeitschrift für anorganische und allgemeine Chemie 1968, 362 (5-6), S. 301-311. doi 10.1002/zaac.19683620510
- ↑ N. I. Nikitina,Z. K. Nikitina: "Thermolysis of disubstituted lithium and sodium orthoperiodates" in Russian Journal of Inorganic Chemistry 2007, 52 (4), S. 535–541. doi 10.1134/S0036023607040031
Enlaces externos


