Perfluorooctano
| Perfluorooctano | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1,1,1,2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-Octadecafluorooctano | ||
| General | ||
| Otros nombres | PF5080 | |
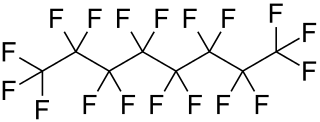
| Fórmula semidesarrollada | CF3-CF2-CF2-CF2-CF2-CF2-CF2-CF3 | |
| Fórmula estructural |
| |
| Fórmula molecular | C8F18 | |
| Identificadores | ||
| Número CAS | 307-34-6[1] | |
| Número RTECS | RG9701000 | |
| ChEBI | 38826 | |
| ChemSpider | 9018 | |
| DrugBank | 15997 | |
| PubChem | 9387 | |
| UNII | 6P60ZBK0QL | |
| Propiedades físicas | ||
| Apariencia | incoloro, inodoro | |
| Densidad | 1733 kg/m³; 1,733 g/cm³ | |
| Masa molar | 438 g/mol | |
| Punto de fusión | 248,15 K (−25 °C) | |
| Punto de ebullición | 376,55 K (103 °C) | |
| Viscosidad | 1,8 g/ml | |
| Índice de refracción (nD) | 1,27 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El perfluorooctano o octadecafluorooctano está constituido por una cadena de 8 átomos de carbono (octano) con átomos de flúor como únicos sustituyentes. Por tanto su fórmula molecular corresponde a C8F18.
Pertenece a la familia de los perfluorocarbonos (PCFs) que está formada por todos aquellos compuestos cuya fórmula molecular general viene dada por CnF2n+2, n=5-9.
Debido a sus propiedades físico-químicas el perfluorooctano se puede considerar un disolvente neotérico.
La principal aplicación de este compuesto es en oftalmología, aunque también puede utilizarse como componente en sistemas bifásicos fluorados para la síntesis de otras sustancias.
Propiedades físico-químicas[editar]
El perfluorooctano es un líquido claro, incoloro e inodoro cuyo peso molecular es de 438 g/mol. Su temperatura de ebullición es de 103.4 °C y presenta una temperatura de fusión de -27 °C. Mientras, el octano, con peso molecular de 114.22 g/mol, tiene la temperatura de ebullición algo superior (127,7 °C) y la temperatura de fusión mucho menor (-56.8 °C).
A 25 °C presenta una densidad de 1,733 g/ml, una viscosidad dinámica de 1,8 g/ml y una densidad de vapor de 0,0131 g/ml. Su presión de vapor es de 1850 Pa.
Tiene un índice de refracción de 1,27 (a 20 °C) debido a que los átomos de flúor son poco polarizables. La tensión superficial es de 14 mN/m y la solubilidad de O2 (%) de 48-52 en el perfluorooctano.
No presenta propiedades explosivas, ni oxidantes y tampoco es inflamable. En cambio el octano es altamente inflamable (13 °C) y presenta una temperatura de autoignición a 220 °C.
Como compuesto fluorado que es presenta un importante carácter apolar. Los enlaces C-F presentan una energía de enlace de 485 kJ/mol y los C-H de 84 kJ/mol, por eso es una sustancia química y bioquímicamente estable.
Es insoluble en agua (< 25 ppm) y soluble en pequeña cantidad en los disolventes orgánicos más comunes, siendo miscible con clorofluorocarbonos (CFC`s).
El perfluorooctano no es tóxico y es extremadamente estable. Es un compuesto volátil, con una presión de vapor de 1850 Pa y con una baja tensión superficial (14 mN/m), por lo que pasa a la atmósfera con facilidad. Además es capaz de pasar a aguas subterráneas. No es biodegradable por lo que va a persistir en el ambiente mucho tiempo, pero tampoco es bioacumulable.
Síntesis del Perfluorooctano[editar]
El perfluorooctano, además del resto de perfuorocarbonos, se sintetiza diluyendo el hidrocarburo en un gas inerte (nitrógeno) y añadiendo fluoruro de cobalto (CoF3) a una temperaturo de 300 °C.
La reacción no se puede llevar a cabo directamente con flúor ya que es muy exotérmica.
Aplicaciones[editar]
Oftalmología[editar]
Uno de los usos del perfluorooctano es en la cirugía vitroretiniana durante la cual se necesitan sustancias que permitan la manipulación de tejidos. La elección de este compuesto se debe a sus buenas propiedades físicas, pero presenta el inconveniente de que es caro.
Esta cirugía se lleva a cabo cuando se da un desprendimiento de retina. Lo que sucede es que esta capa del ojo se rompe y el líquido que existe en la cavidad vítrea traspasa la retina. En estos casos la vitrectomía y la inyección de un líquido fluoroso, como es el perfluorooctano, permiten que se readhiera la retina.
Síntesis de compuestos orgánicos[editar]
El perfluorooctano, al igual que otros perfluorocarbonos, puede utilizarse para constituir sistemas bifásicos fluorados. La ventaja de utilizar sistemas bifasicos fluorados en síntesis es que se puede trabajar con catalizadores homogéneos de tal forma que no van a ser envenenados por el producto de la reacción, se van a poder recuperar tras ella y la purificación del producto es mucho más fácil.
En el caso de la oxidación de sulfuros con PhIO se puede utilizar un sistema bifasico CH3CN / n-perfluorooctano. El n-perfluorooctano va a permitir la disolución del catalizador, que en este caso es una sal fluorada de manganeso (III), y se va a incrementar la selectividad a sulfóxido en comparación con lo obtenido bajo condiciones homogéneas.
Otro caso en el que se utiliza el perfluorooctano es en la síntesis de 1,5-benzoazepinas. Las benzoazepinas son agentes antipiréticos, anticonvulsionantes, ansiolíticos, antitumolares, hipnóticos y sus derivados son agentes antiinflamatorios. Su síntesis tradicional presenta numerosas reacciones. Otra opción para llevar a cabo la síntesis es utilizar una emulsión constituida por n-perfluorooctano y perfluorooctanosulfonato de litio bajo condiciones aeróbicas a temperatura ambiente.
Sulfonato de perfluorooctano[editar]
Es un derivado del perfluooroctano y se comercializan en forma de sales, derivados y polímeros, utilizada para proporcionar resistencia a la grasa, al aceite y al agua en diversos materiales.
Los estudios de evaluación de riesgo efectuados han demostrado su peligrosidad, por ser un compuesto muy persistente, bioacumulable y tóxico para los mamíferos y, en consecuencia, con el fin de garantizar un elevado nivel de protección de salud y del medio ambiente, se ha acordado la limitación de su uso, con algunas excepciones debido a lo reducido de sus aplicaciones y a la carencia de productos alternativos, éste es el caso de los procesos de cromado, de fotografía, de fotolitografía, espumas antiincendio y de fluidos hidráulicos para la aviación. Estos límites quedan regulados por la Directiva 2006/122/CE referente a la comercialización y el uso de determinadas sustancias y preparados peligrosos (sulfonatos de perfluorooctano).
Referencias[editar]
Pulido, José S. Retina, Coroides y vítreo. Los requisitos en oftalmología. Madrid: Elsevier España; 2002.
Menz Dirk-Henning, Dresp Joachim H. Biocompatibility of Highly Fluorinated Liquids Used in Ophthalmic Surgery. Fluorine and Health. 2008, 421-45.
Dias A.M.A. , Caço A.I. , Coutinho J.A.P. , Santos L.M.N.B.F. , Piñeiro M.M. , Vega L.F. , Costa Gomes M.F. , Marrucho I.M. Thermodynamic properties of perfluoro-n-octane. Fluid Phase Equilibria. 2004;225:39-47.
Cavazzini Marco , Pozzi Gianluca , Quici Silvio , Shepperson Ian. Fluorous biphasic oxidation of sulfides catalysed by (salen)manganese(III) complexes. Journal of Molecular Catalysis A: Chemical. 2003;204-205:433-41.
Yi Wen-Bin , Cai Chun. The synthesis of 1,5-benzodiazepines in a fluorous aqueous emulsion. Journal of Fluorine Chemistry. 2009;130:1054-58.
- L.Ritter, Howard (1956). Introducción a la química. Editorial Reverte.
