Monocuerpo
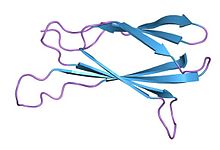

Los monocuerpos son proteínas de unión sintéticas que se construyen utilizando un dominio de fibronectina tipo III (FN3) como andamio molecular. Los monocuerpos son una alternativa simple y robusta a los anticuerpos para la creación de proteínas específicas.El término "monocuerpo" fue acuñado en 1998 por el grupo de Koide que publicó el primer artículo demostrando el concepto de monocuerpo usando el tercer dominio de tipo III de la fibronectina humana.[1]
Los monocuerpos se generan a partir de bibliotecas combinatorias en las que las porciones del andamio FN tipo 3 se diversifican utilizando visualización molecular y tecnologías de evolución dirigida como la presentación de fagos, la presentación en mRNA y la presentación en superficie en levaduras.[2][3] Se ha informado de un gran número de monocuerpos que tienen alta afinidad y alta especificidad hacia sus respectivos objetivos.[4][5][6][7][8]
Los monocuerpos pertenecen a la clase de moléculas llamadas colectivamente anticuerpomiméticos (o miméticos de anticuerpos) y andamios alternativos que buscan superar las limitaciones de los anticuerpos naturales. Una ventaja importante de los monocuerpos frente a los anticuerpos convencionales es que los monocuerpos se pueden usar fácilmente como inhibidores intracelulares codificados genéticamente, es decir, se puede expresar un inhibidor monomodular en una célula elegida simplemente transfectando la célula con un vector de expresión monomodular.[6][7] Esto es debido a las características del andamio subyacente FN3: pequeño (~90 residuos), estable, fácil de producir, y su ausencia de enlaces de disulfuro permite producir mono-cuerpos funcionales independientemente del potencial redox del ambiente celular, incluyendo el medio ambiente reductor del citoplasma y núcleo. Por el contrario, la mayoría de los anticuerpos y fragmentos de anticuerpos dependen de la formación de enlaces disulfuro y deben producirse en un entorno oxidante.
La tecnología de monocuerpos ha sido adoptada en la industria biotecnológica, especialmente por Adnexus, una empresa biotecnológica parte de Bristol-Myers Squibb desde 2007, bajo la denominación comercial Adnectins (originalmente como Trinectinas por su predecesor, Phylos).[9] Un ejemplo es el pegdinetanib (Angiocept), un antagonista del receptor 2 del factor de crecimiento endotelial vascular (VEGFR-2), que ha entrado en ensayos clínicos de fase II que investigan el tratamiento del glioblastoma en octubre de 2007.[10]
Estructura[editar]
El andamio nativo FN3 consta de 94 aminoácidos y tiene una masa molecular de unos 10 kDa, quince veces más pequeño que un anticuerpo tipo IgG y comparable al tamaño de un solo dominio variable de un anticuerpo. Se basan en la estructura de la fibronectina humana, más específicamente en su décimo dominio extracelular de tipo III. Este dominio tiene una estructura similar a los dominios variables de anticuerpos, con siete hojas beta formando un sándwich beta y tres bucles expuestos en cada lado correspondientes a las tres regiones determinantes de la complementariedad.[11][4][5] Los monocuerpos carecen de sitios de unión para iones metálicos y el enlace disulfuro central.
Bibliotecas de diseño de monocuerpos[editar]
Se pueden generar monocuerpos de alta afinidad y especificidad para diferentes moléculas diana a partir de librerías combinatorias en las que se diversifican porciones del andamio FN3. El primer tipo modifica algunos o todos los bucles BC (entre la segunda y tercera hojas beta), DE (entre la cuarta y quinta hoja beta) y FG (entre la sexta y séptima hoja).[1][4] Este diseño crea diversas posiciones en una superficie convexa que es adecuada para apuntar a superficies cóncavas como sitios activos de enzimas. El segundo tipo modifica posiciones en algunas o todos las cadenas C, D, F y G (o el 3º, 4º, 6º y 7º) además de los bucles CD y FG. Este diseño crea una superficie más plana y ligeramente cóncava que es adecuada para dirigirse a superficies que normalmente están involucradas en interacciones proteína-proteína.
Véase también[editar]
Referencias[editar]
- ↑ a b «The fibronectin type III domain as a scaffold for novel binding proteins». J. Mol. Biol. 284: 1141-51. December 1998. PMID 9837732. doi:10.1006/jmbi.1998.2238.
- ↑ «Target-binding proteins based on the 10th human fibronectin type III domain (¹⁰Fn3)». Meth. Enzymol. 503: 135-56. 2012. PMID 22230568. doi:10.1016/B978-0-12-396962-0.00006-9.
- ↑ «Teaching an old scaffold new tricks: monobodies constructed using alternative surfaces of the FN3 scaffold». J. Mol. Biol. 415: 393-405. 2012. PMC 3260337. PMID 22198408. doi:10.1016/j.jmb.2011.12.019.
- ↑ a b c «A potent and highly specific FN3 monobody inhibitor of the Abl SH2 domain». Nat. Struct. Mol. Biol. 17: 519-27. 2010. PMC 2926940. PMID 20357770. doi:10.1038/nsmb.1793.
- ↑ a b «Isoform-specific monobody inhibitors of small ubiquitin-related modifiers engineered using structure-guided library design». Proc. Natl. Acad. Sci. U.S.A. 108: 7751-6. May 2011. PMC 3093456. PMID 21518904. doi:10.1073/pnas.1102294108.
- ↑ a b «Targeting the SH2-kinase interface in Bcr-Abl inhibits leukemogenesis». Cell 147: 306-19. 2011. PMC 3202669. PMID 22000011. doi:10.1016/j.cell.2011.08.046.
- ↑ a b «Dissection of the BCR-ABL signaling network using highly specific monobody inhibitors to the SHP2 SH2 domains». Proc. Natl. Acad. Sci. U.S.A. 110: 14924-9. 2013. PMC 3773763. PMID 23980151. doi:10.1073/pnas.1303640110.
- ↑ «Proof of dual-topology architecture of Fluc F- channels with monobody blockers». Nat Commun 5: 5120. 2014. PMC 4265568. PMID 25290819. doi:10.1038/ncomms6120.
- ↑ «Directed evolution of high-affinity antibody mimics using mRNA display». Chem. Biol. 9: 933-42. 2002. PMID 12204693. doi:10.1016/s1074-5521(02)00187-4.
- ↑ «FN3: a new protein scaffold reaches the clinic». Drug Discov. Today 14 (19–20): 949-55. July 2009. PMID 19576999. doi:10.1016/j.drudis.2009.06.007.
- ↑ «Monobodies: antibody mimics based on the scaffold of the fibronectin type III domain». Methods Mol. Biol. 352: 95-109. 2007. PMID 17041261. doi:10.1385/1-59745-187-8:95.
