Luciferina (molécula)

La luciferina es una molécula responsable de la emisión de luz (bioluminiscencia) en algunas bacterias (como Vibrio fischeri), algas, hongos y animales (bien por contener esta molécula, bien por tener bacterias endosimbióticas que la tienen). Un ejemplo es la luminiscencia de las luciérnagas. Estos compuestos son el sustrato de enzimas denominadas luciferasas[1] [2][3][4] o fotoproteínas,[5][6] que llevan a cabo la descarboxilación oxidativa de la luciferina usando oxígeno (O2), lo que causa la producción de luz.
Historia
Las primeras investigaciones sobre el sistema de luciferina-luciferasa se le atribuyen al francés Raphaël Dubois. Él descubrió mediante el trabajo con luciérnagas en 1885 y con el bivalvo Pholas dactylus en 1887, que en el fenómeno de la bioluminiscencia existían un par de sustancias; una de ellas se consumía en presencia de la otra que actuaba como catalizador y cuya consecuencia era la emisión de luz por parte de algunos organismos. Dicha sustancia que se consumía el la denominó luciferina, la cual no se destruye por el calor. El otro componente lábil al calor, descrito por Dubois la denominó luciferasa. Hoy en día, la luciferasa es la enzima que convierte la luciferina en asociado reducido.[7][8][9][10][11]
Las siguientes investigaciones fueron realizadas por el estadounidense Edmund Newton Harvey a principio del siglo XX.[7][12][13][11] Él encontró que hay una especificidad del sistema luciferina-luciferasa para las diferentes especies. Así luciferinas de una especie no puede ser producida por otra especie.[8][13][11] Por último, cualquier sistema bioluminiscente requiere oxígeno, lo que ya había sido observado por Robert Boyle en el siglo XIX.[7][13][11]
Al parecer los sistemas bioluminiscentes no guardan relación evolutiva entre ellos, es decir no son homólogos. Al parecer dicho proceso se presentan en unos 17 grupos de insectos diferentes y en por lo menos unas 700 especies adicionales en su gran mayoría marinas.[14] Se han desarrollado una gran cantidad de estudios filogenéticos de los sistemas luciferina-luciferasa, y se han hallado más 30 orígenes independientes.[15][11]
Variantes de luciferina
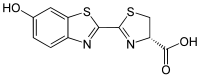
Las luciferinas son una clase de pequeñas moléculas que actúan como sustratos oxidándose en presencia de la enzima luciferasa para producir oxiluciferina y la energía en forma de luz. Hay muchos tipos de luciferinas, pero todos comparten el uso de especies reactivas de oxígeno para emitir luz. Según las distintas especies de animales la composición química de la luciferasa y de la luciferina varía, lo que produce colores distintos. No se sabe exactamente cuántos tipos de luciferinas existen, pero algunos de los compuestos más estudiados son los siguientes.[16]
Luciferina de luciérnagas
Luciferina de luciérnagas se encuentra en muchas especies la familia Lampyridae. Es el sustrato de la luciferasa (CE 1.13.12.7) responsable de la emisión de luz amarilla característica de luciérnagas. La química es inusual, ya que se encontró que el ATP es necesario para la emisión de luz.[17]
Luciferina de caracoles

También conocida como Latia luciferina su fórmula química es (E)-2-metil-4-(2,6,6-trimetil-1-ciclohex-1-il)-1-buten-1-ol formato, es característica del caracol de agua dulce Latia neritoides[18]
Luciferina bacteriana
Luciferina bacteriana es un tipo de luciferina se encuentra en bacterias, las cuales viven dentro de los tejidos especializados de algunos calamares y peces. Se compone de un aldehído de cadena larga y una de riboflavina fosfato reducida.
Coelenteracina

La coelenteracina se encuentra en radiolarios, ctenóforos, cnidarios, calamares, copépodos, quetognatos, los peces y camarones. Es el grupo prostético en la que proteína aequorin es la responsable de la emisión de luz azul.[19][20][21]
Luciferina de los dinoflagelados
La luciferina de los dinoflagelados es un derivado de la clorofila y se encuentra en los dinoflagelados, los cuales son a menudo responsables del fenómeno de la bioluminiscencia del océano durante la noche. Un tipo muy similar de la luciferina se encuentra en algunos tipos de camarones eufáusidos. Pehr Löfling el 8 de abril de 1754 Y Alejandro de Humboldt el 19 de agosto de 1799 estudiaron este fenómenos en las aguas marinas de las aguas de la península de Araya[22][23][24][25][26]
Vargulina

La vargulina se encuentra en ostrácodos (Vargula hilgendorfii)[27][28][29] y algunos peces de aguas profundas, para ser específicos, Porichthys. Al igual que el coelenteracina es un compuesto, de un imidazopirazonina, y permite la emisión de una luz azul en los animales que la presentan.
Véase también
Referencias
- ↑ Colin Nicol, J.A. (1969): Biology of marine animals. Pitman Paperbacks. London. 699p.
- ↑ Lehninger, Albert L. (1975): Bioenergética. Fondo Educativo Interamericano, S.A. México, D.F. 242p.
- ↑ Lehninger, Albert L. (1983): Bioquímica. Ediciones Omega, S.A. Barcelona. 1117p. ISBN 84-282-0211-7
- ↑ Atlas, Ronald M. (Editor). (1996): Principles of Microbiology. WCB/McGraw-Hill. Boston. 1298p. ISBN 0-8151-0889-3
- ↑ Hastings J.W. (1996): Chemistries and colors of bioluminescent reactions: a review. Gene 173(1):5–11
- ↑ Shimomura, O. (2006): "Bioluminescence: Chemical Principles and Methods" World Scientific Publishing Co.
- ↑ a b c Kanda, Sakyo. (1920): Physico-chemical studies on bioluminiscence. I. On the Luciférine and Lusiférase of Cypridina hilgendor. Am. J. Physiol., 50:(4) 544-560
- ↑ a b McElroy, William D. y Seliger, Howard H.. (1962): Bioluminiscencia. En: La célula viva. Selecciones de Scientific American. Editorial Blume, S.A. Madrid 1970. pp:184-197.
- ↑ Novikoff, Mikhail M. (1963): Los órganos luminosos. En Novikoff, Mikhail M. Fundamentos de la morfología comparada de los invertebrados. Editorial Universitaria de Buenos Aires. Buenos Aires. Pp:205-208.
- ↑ Prosser, C. Ladd & Brown, Frank A. (1968): Bioluminiscencia. En: Prosser, C. Ladd & Brown, Frank A. Fisiología comprada. Editorial Intermaricana, S.A. México, D.F. Pp:526-538.
- ↑ a b c d e Lee, John. (2008): Bioluminescence: the First 3000 Years (Review). Journal of Siberian Federal University. Biology 3:194-205 PDF
- ↑ Harvey, E.N. (1952): Bioluminescence. Academic, New York. 649 pp.
- ↑ a b c Lee, John. A history of bioluminescence kttp://www.photobiology.info/HistBiolum.html
- ↑ Hastings, J.W. (2001): Bioluminescence. (N. Sperelakis, ed.)., in: Cell Physiology, Dritte Edition, Academic Press, New York. Pp:1115–1131.
- ↑ Herring PJ. (1987): Systematic distribution of bioluminescence in living organisms, in: J Biolumin Chemilumin. 1 (3); 147–163; PMID 3503524.
- ↑ Hastings, J.W. (1983): Biological diversity, chemical mechanisms, and the evolutionary origins of bioluminescent systems. Journal of Molecular Evolution, 19(5):309-321
- ↑ McElroy, W.D. & Green, Arda. (1956): Function of adenosine triphosphate in the activation of luciferin. Archives of Biochemistry and Biophysics, 64(2): 257–271
- ↑ EC 1.14.99.21. ORENZA: a database of ORphan ENZyme Activities, accessed 27 November 2009.
- ↑ Shimomura, O. & Johnson, F. H. (1975): Chemical nature of bioluminescence systems in coelenterates. Proc Natl Acad Sci U S A. 72(4):1546-1549
- ↑ Failla Siquier, Gabriela. (2010): Medusas y peines de mar. Almanaque 2010. http://www.bse.com.uy/almanaque/Almanaque%202010/articulos/parte-1/pdf/conociendo-al-plancton-gelatinoso.pdf
- ↑ Muy Interasanste: Osamu Shimomura: "Entender por qué algunos animales emiten luz es clave para la ciencia" http://www.muyinteresante.es/osamu-shimomura-qentender-por-que-algunos-animales-emiten-luz-es-clave-para-la-cienciaq/imprimir
- ↑ Diccionario Multimedia de Historia de Venezuela., (1995): “Löfling, Pehr”. Fundación Polar., Caracas.
- ↑ Giraldo, Manuel. y Antonio E. de Pedro. (1992): “La frontera caribica: Expedición de límites al Orinoco 1745/1761”. Cuadernos Lagoven Serie Medio Milenio, Lagoven, S.A. Caracas. ISBN 980-259-500-4
- ↑ Pelayo, Francisco. y Miguel Ángel Puig-Samper. (1992): "La obra científica de Löfling en Venezuela"., Cuadernos Lagoven Serie Medio Milenio, Lagoven, S.A. Caracas. ISBN 980-259-501-2
- ↑ Humboldt, Alejandro de. (1991): “Viaje a las regiones equinocciales del Nuevo Continente”. (2.ª ed.). Monte Ávila Editores. Caracas – Venezuela. 5 volúmenes.
- ↑ Veracoechea De Castillo, Luisa. (1998). “Alejandro de Humboldt en Venezuela. Segundo Centenario de su viaje a América”. Cuadernos PDVSA. Petróleos de Venezuela, S.A. Caracas – Venezuela. 166p.
- ↑ Nakajima, Yoshihiro; et al. (2004). "cDNA Cloning and Characterization of a Secreted Luciferase from the Luminous Japanese Ostracod, Cypridina noctiluca". Japan Science and Technology Information Aggregator, Electronic. http://www.jstage.jst.go.jp/article/bbb/68/3/565/_pdf.
- ↑ Thompson, Eric M.; Shigekazu Nagata and Frederick I. Tsuji (1989): "Cloning and expression of cDNA for the luciferase from the marine ostracod Vargula hilgendorfii". Proceedings of the National Academy of Sciences 86 (17): 6567–6571. doi:10.1073/pnas.86.17.6567. JSTOR 34574. PMC 297885. PMID 2771943. http://www.pnas.org/content/86/17/6567.full.pdf+html. Retrieved 8 February 2010.
- ↑ Harvey, E. N. (1916): "Studies on bioluminescence". American Journal of Physiology 42 (2): 318–341. http://ajplegacy.physiology.org/cgi/reprint/42/2/318.pdf.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Luciferina.
Wikimedia Commons alberga una categoría multimedia sobre Luciferina.- Bahías Bioluminscentes: ¿Qué es Bioluminiscencia? Jennie T. Ramírez
- Vargulin: all facts at a glance
- Major luciferin types. The Bioluminescence Web Page. University of California, Santa Bárbara
- Un outil pedagogique original: la bioluminescence
- La bioluminescence, une lumineuse invention de la nature. Kamil Fadel Décou Verten ° 3 2 9 Juil. - Aoot- Sept. 2005
