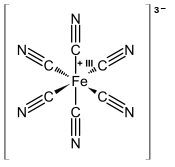
Ferricianuro de potasio
Ferricianuro potásico, también conocido como Rojo de Prusia, es un compuesto químico con la fórmula K4[Fe(CN)6] Esta sal de color rojo brillante consiste en la coordinación del compuesto [Fe(CN)6]3−].[1] Es soluble en agua y su solución muestra alguna fluorescencia verde-amarilla.
Preparación
El ferricianuro potásico se fabrica pasando cloro a través de una solución de ferrocianuro potásico. El ferricianuro potásico se separa de la solución:
- 2 K4[Fe(CN)6] + Cl2 → 2 K3[Fe(CN)6] + 2 KCl
Usos
Es utilizado como componente base en la preparación del reactivo de Drabkin, utilizado para pruebas cuantitativas de hemoglobina en sangre.[2]
El fundamento de la reacción consiste en que el Fe (ΙΙ) de todas las formas de hemoglobina, con excepción de la sulfohemoglobina, es oxidado por el ferricianuro a Fe(ΙΙΙ) convirtiéndolas en metahemoglobina que, a la vez, reacciona con cianuro ionizado (CN-) formándose cianmetahemoglobina, un derivado muy estable que absorbe a 540 nm. La intensidad del color formado es proporcional a la concentración de hemoglobina total en la muestra.[3]
Reacción:
HbFe (ΙΙ) + [Fe(ΙΙΙ)(CN)6]3- → HbFe (ΙΙΙ) + [Fe(ΙΙ)(CN)6]4-
HbFe (ΙΙΙ) + CN- → HbFe(ΙΙΙ)CN
pH 7.2
Véase también
Referencias
- ↑ Sharpe, A. G., The Chemistry of Cyano Complexes of the Transition Metals, Academic Press: London, 1976
- ↑ Sharpe, van Kampen, E.J. y Ziljltra, W.G. Clin. Chim. Acta. 6 : 538 (1961).
- ↑ Sharpe,http://www.ihrdiagnostica.com/tecnicas/pdf/Hemoglobinav2.pdf Archivado el 4 de marzo de 2016 en Wayback Machine.