Espectroscopia

La espectroscopia o espectroscopía es el estudio de la interacción entre la radiación electromagnética y la materia, con absorción o emisión de energía radiante. Tiene aplicaciones en astronomía, física, química y biología, entre otras disciplinas científicas.
El análisis espectral se basa en detectar la absorción o emisión de radiación electromagnética a ciertas longitudes de onda, en relación con los niveles de energía implicados en una transición cuántica.
Existen tres casos de interacción con la materia:
- choque elástico: existe sólo un cambio en el impulso de los fotones (por ejemplo, los rayos X, la difracción de electrones y la difracción de neutrones);
- choque inelástico: por ejemplo, la espectroscopia Raman;
- absorción o emisión resonante de fotones.
Aspectos generales
El mecanismo por el cual la materia emite radiación electromagnética es el dominio de la espectroscopia. La radiación electromagnética se atribuye a las diferencias de energía en las transiciones de los electrones de unos niveles atómicos a otros. La espectroscopia se relaciona en la mayoría de los casos con la tercera interacción. Estudia en qué frecuencia o longitud de onda una sustancia puede absorber o emitir energía en forma de un cuanto de luz.
La energía de un fotón (un cuanto de luz) de una onda electromagnética o su correspondiente frecuencia equivale a la diferencia de energía entre dos estados cuánticos de la sustancia estudiada:
donde es la constante de Planck, es la frecuencia del haz de luz u onda electromagnética asociada a ese cuanto de luz y es la diferencia de energía. Esta ecuación es conocida también como la ecuación básica de la espectroscopia. Las diferencias de energía entre estados cuánticos dependen de la composición elemental de la prueba o de la estructura de la molécula, y por eso este método proporciona información importante para astrónomos, físicos, químicos y biólogos.
Por medio de un espectrofotómetro se mide el espectro de la luz (intensidad de la luz absorbida, reflejada o emitida en función de la frecuencia o de la longitud de onda). Los espectros se diferencian considerablemente de elemento a elemento.
Definición de espectro
En general, se denomina espectro a la distribución de la intensidad en función de la frecuencia o de la longitud de onda.
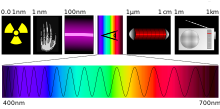
Además de la luz visible, la espectroscopia cubre hoy en día una gran parte del espectro electromagnético, que va de los infrarrojos hasta los rayos gamma.
Objetivo de la espectroscopía
El objetivo de la espectroscopia es obtener información acerca de una prueba o de un cuerpo radiante. Por ejemplo:
- la estructura interna o la temperatura (por ejemplo de estrellas);
- la composición o la cinética de una reacción química;
- la espectroscopia analítica identifica átomos o moléculas por medio de sus espectros.
Etimología y ortografía
Por analogía con otras palabras que designan ramas de la ciencia, es frecuente «romper» el diptongo final convirtiendo «espectroscopia» en «espectroscopía» (nótese la tilde sobre la i). Tanto la forma con diptongo (ia), como la forma con hiato (ía) acorde con la pronunciación etimológica griega, son aceptadas por la Real Academia Española.
Antecedentes históricos
La luz visible es físicamente idéntica a todas las radiaciones electromagnéticas. Es visible para el ser humano, porque el ojos detecta esta estrecha banda de radiación del espectro electromagnético completo. Esta banda es la radiación dominante que emite el Sol.
Desde la antigüedad, científicos y filósofos han especulado sobre la naturaleza de la luz. La comprensión moderna de la luz comenzó con el experimento del prisma de Isaac Newton, con el que comprobó que cualquier haz incidente de luz blanca, no necesariamente procedente del Sol, se descompone en el espectro del arco iris (del rojo al violeta). Newton tuvo que esforzarse en demostrar que los colores no eran introducidos por el prisma, sino que realmente eran los constituyentes de la luz blanca. Posteriormente, se pudo comprobar que cada color correspondía a un único intervalo de frecuencias o longitudes de onda.
En los siglos XVIII y XIX, el prisma usado para descomponer la luz fue reforzado con rendijas y lentes telescópicas con lo que se consiguió así una herramienta más potente y precisa para examinar la luz procedente de distintas fuentes. Joseph von Fraunhofer, astrónomo y físico, utilizó este espectroscopio inicial para descubrir que el espectro de la luz solar estaba dividido por una serie de líneas oscuras, cuyas longitudes de onda se calcularon con extremo cuidado. Por el contrario, la luz generada en laboratorio mediante el calentamiento de gases, metales y sales mostraba una serie de líneas estrechas, coloreadas y brillantes sobre un fondo oscuro. La longitud de onda de cada una de estas bandas era característica del elemento que había sido calentado. Por entonces, surgió la idea de utilizar estos espectros como huella digital de los elementos observados. A partir de ese momento, se desarrolló una verdadera industria dedicada exclusivamente a la realización de espectros de todos los elementos y compuestos conocidos.
También se descubrió que, si se calentaba un elemento lo suficientemente (incandescente), producía luz blanca continua, un espectro completo de todos los colores, sin ningún tipo de línea o banda oscura en su espectro. En poco tiempo llegó el progreso: se pasó la luz incandescente de espectro continuo por una fina película de un elemento elegido que estaba a temperatura menor. El espectro resultante tenía líneas oscuras, idénticas a las que aparecían en el espectro solar, precisamente en las frecuencias donde el elemento particular producía sus líneas brillantes cuando se calentaba. Es decir, cada elemento emite y absorbe luz a ciertas frecuencias fijas características del mismo.
Las líneas oscuras de Fraunhofer, que aparecían en el espectro solar, son el resultado de la absorción de ciertas frecuencias características por los elementos presentes en las capas más exteriores de nuestra estrella (espectro de absorción). Aún había dudas: en 1878, en el espectro solar se detectaron líneas que no casaban con las de ningún elemento conocido. De ello, los astrónomos predijeron la existencia de un elemento nuevo, llamado helio. En 1895 se descubrió el helio terrestre.
De igual forma que la teoría universal de la gravitación de Newton probó que se pueden aplicar las mismas leyes tanto en la superficie de la Tierra como para definir las órbitas de los planetas, la espectroscopia demostró que existen los mismos elementos tanto en la Tierra como en el resto del Universo.
Relación con el estudio de los astros
Los astros, así como la materia interestelar, emiten ondas electromagnéticas; los astrónomos han llegado al conocimiento de cuanto sabemos del ámbito extraterrestre descifrando los mensajes que portan esas ondas cuando llegan a nuestro planeta. Debe advertirse que la emisión y las modificaciones ulteriores experimentadas por esas radiaciones son resultado de no pocos factores: la composición elemental de la fuente que los emite, temperatura, presión y grado de ionización a que se halla la misma, influencia de los campos magnéticos y eléctricos, etc. Por otra parte, como los astrónomos y físicos han reproducido en sus laboratorios esos diferentes estados de la materia y obtenido los espectros correspondientes, éstos sirven de patrones que permiten analizar los espectros de los cuerpos celestes y extraer toda la información que contienen. En el caso de los espectros luminosos, los estudios constituyen el análisis espectral.
Además de indicar la composición elemental de la fuente luminosa y el estado físico de su materia, el espectro revela si el cuerpo luminoso y la Tierra se acercan o se alejan entre sí, además de indicar la velocidad relativa a la que lo hacen (efecto Doppler-Fizeau).
Campos de estudio
| Espectroscopia atómica | ||
|---|---|---|
| Técnica | Excitación | Relajación |
| Espectroscopia de absorción atómica |
UV-vis | Calor |
| Espectroscopia de emisión atómica |
Calor | UV-vis |
| Espectroscopia de fluorescencia atómica |
UV-vis | UV-vis |
| Espectroscopia de rayos X |
Rayos X | Rayos X |
| Espectroscopia molecular | ||
| Técnica | Radiación electromagnética | |
| Espectroscopia de resonancia magnética nuclear |
Radiofrecuencias | |
| Espectroscopia de microondas | Microondas | |
| Espectroscopia infrarroja | Infrarrojo | |
| Espectroscopia ultravioleta-visible |
Ultravioleta-visible | |
| Espectroscopia de fluorescencia ultravioleta-visible |
Ultravioleta-visible | |
- espectroscopia de impedancia electrodinámica (EIS)
- espectroscopia de microondas
- espectroscopia de rayos X
- espectroscopia de resonancia magnética nuclear
- espectroscopia infrarroja
- espectroscopia ultravioleta-visible
Véase también
- dispersión inelástica de neutrones
- espectro de frecuencias
- espectrómetro
- historia de la espectroscopia
- métodos espectrométricos
Enlaces externos
- Espectrometria.com Información sobre técnicas espectroscópicas
- NIST - Basic Atomic Spectroscopy Data (En inglés) Una selección de los datos de espectroscopia atómica más importantes y más frecuentemente usados
- Espectroscopia de nanohilos




