Diferencia entre revisiones de «Saponificación»
Sin resumen de edición |
m Revertidos los cambios de 201.252.2.130 (disc.) a la última edición de BlackBeast |
||
| Línea 21: | Línea 21: | ||
*[http://www.pinsapo.com/modules.php?name=News&file=article&sid=207 Tablas de Saponificación I] |
*[http://www.pinsapo.com/modules.php?name=News&file=article&sid=207 Tablas de Saponificación I] |
||
*[http://www.pinsapo.com/modules.php?name=News&file=article&sid=208 Tablas de Saponificación II] |
*[http://www.pinsapo.com/modules.php?name=News&file=article&sid=208 Tablas de Saponificación II] |
||
== Véase También == |
|||
[[Judío]] |
|||
[[Jabón]] |
|||
[[Categoría:Reacciones químicas orgánicas]] |
[[Categoría:Reacciones químicas orgánicas]] |
||
Revisión del 20:40 2 ago 2010
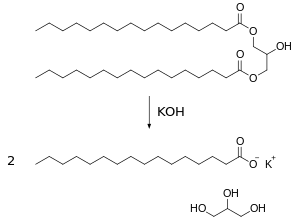
La saponificación es una reacción química entre un ácido graso (o un lípido saponificable, portador de residuos de ácidos grasos) y una base o álcalino, en la que se obtiene como principal producto la sal de dicho ácido y de dicha base. Estos compuestos tienen la particularidad de ser anfipáticos, es decir tienen una parte polar y otra apolar (o no polar), con lo cual pueden interactuar con sustancias de propiedades dispares. Por ejemplo, los jabones son sales de ácidos grasos y metales alcalinos que se obtienen mediante este proceso.
El método de saponificación en el aspecto industrial consiste en hervir la grasa en grandes calderas, añadiendo lentamente sosa cáustica (NaOH), agitándose continuamente la mezcla hasta que comienza esta a ponerse pastosa.
La reacción que tiene lugar es la saponificación y los productos son el jabón y la glicerina:
Grasa + sosa cáustica → jabón + glicerina
Lípidos saponificables
Antes que nada habria que dirimir entre un lipido saponificable y uno insaponificable a pesar que los enlaces son muy similares existe una diferencia entre los enlaces covalentes de sus elementos. Un lípido saponificable sería todo aquel que esté compuesto por un alcohol unido a uno o varios ácidos grasos (iguales o distintos). Esta unión se realiza mediante un enlace éster, muy difícil de hidrolizar. Pero puede romperse fácilmente si el lípido se encuentra en un medio básico. En este caso se produce la saponificación alcalina. En los casos en los que para la obtención del jabón se utiliza un glicérido o grasa neutra, se obtiene como subproducto el alcohol llamado glicerina, que puede dar mayor beneficio económico que el producto principal.
En el ejemplo de arriba una molécula de un lípido es tratada con dos de hidróxido de potasio; se obtienen dos moléculas de palmitato de potasio (un jabón) y una de glicerina.
La acción limpiadora del jabón se debe a su poder emulsionante, esto es, su habilidad para suspender en agua sustancias que normalmente no se disuelven en agua pura. La cadena hidrocarbonada (parte hidrofóbica) de la sal (el jabón), tiene afinidad por sustancias no polares, tales como las grasas de los alimentos. El grupo carboxilato (parte hidrofílica) de la molécula tiene afinidad por el agua.
En la solución de jabón, los iones carboxilato rodean a las gotas de grasa: sus partes no polares se ubican (disuelven) hacia adentro, mientras que los grupos carboxilatos se ordenan sobre la superficie externa. Así, reducidas a volúmenes muy pequeños, las gotas pueden asociarse con las moléculas de agua y se facilita la dispersión de la grasa. Estas pequeñas gotas que contienen las partículas no polares rodeadas de aniones carboxilato se denominan micelas. Es la presencia de estos aniones carboxilato la que hace que las superficies de las micelas estén cargadas negativamente y se repelan entre sí, impidiendo la coalescencia y manteniendo la emulsión, es decir la dispersión en gotas muy finas.
