Diferencia entre revisiones de «Lisozima»
m Bot: Marca para revisión errores comunes. ¿Fue un error?, repórtalo aquí |
Revertidos los cambios de Paco Bami a la última edición de 201.173.240.142 usando monobook-suite |
||
| Línea 42: | Línea 42: | ||
== Referencias == |
== Referencias == |
||
{{listaref}} |
{{listaref}} |
||
Es simplemente para corregir una error ortográfico en la frase en donde se expresa la palabra "descripta" que debe ser "descrita".--[[Usuario:Paco Bami|Paco Bami]] ([[Usuario Discusión: {{revisar}}Paco Bami|discusión]]) 18:28 11 mar 2010 (UTC)19:18h del 11-03-2010 |
|||
== Enlaces externos == |
== Enlaces externos == |
||
Revisión del 20:28 13 mar 2010
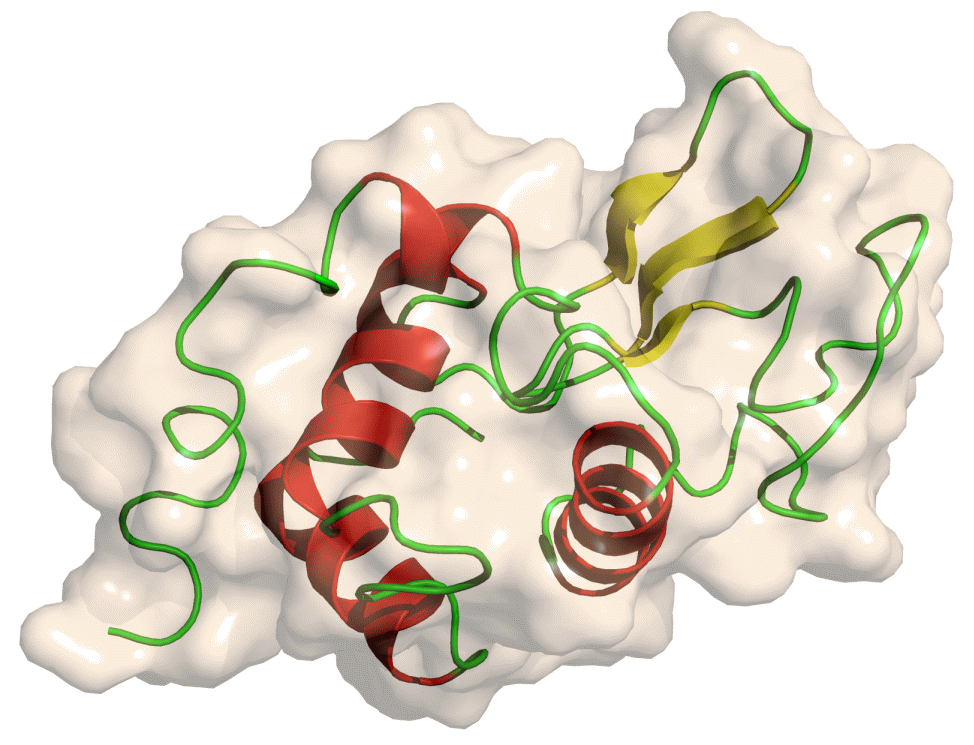
| Lisozima | ||||
|---|---|---|---|---|
 | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolo | LYZ (HGNC: 6740) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 3.2.1.17 | |||
| Locus | Cr. 12 q15 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
La lisozima, también llamada muramidasa, es una enzima de 14,4 kilodalton que daña las células bacterianas catalizando la hidrólisis de las uniones beta 1,4 entre los residuos de ácido N-acetilmurámico y N-acetil-D-glucosamina en un peptidoglicano. La lisozima es abundante en numerosas secreciones como la saliva, las lágrimas y el moco. Está presente también en los gránulos citoplasmáticos de los neutrófilos polimorfonucleares PMN. Una gran cantidad de esta enzima puede hallarse en las claras de huevo.
La lisozima es una enzima presente en las lágrimas y la saliva en donde actúa como una barrera frente a las infecciones. También es muy abundante en la clara del huevo, de donde se extrae para su uso industrial, en particular para el control de las bacterias lácticas en los vinos. La lisozima fue descubierta por Fleming, el mismo que descubrió la penicilina. Además de encontrarse en la saliva y en las lágrimas, la lisozima está presente en el bazo, los pulmones, los leucocitos, el plasma, la leche y el cartílago. La deficiencia en lisozima, debida a mutaciones en el gen LYZ situado en el cromosoma 12, ha sido asociada a displasias esqueléticas y a un aumento de la propensión a las infecciones.
Fisiología
La mayoría de las bacterias afectadas por lisozimas no son patogénicas. En algunos casos, la lisozima es la razón principal por la que estos organismos no llegan a ser patogénicos. La lisozima puede actuar como una opsonina innata o como una enzima catalítica. Las lisozimas sirven como opsoninas innatas uniéndose a la superficie bacteriana, reduciendo la carga negativa y facilitando la fagocitosis de las bacterias, todo esto antes de la llegada de las opsoninas del sistema inmunológico. En otras palabras, la lisozima hace que las células fagocíticas puedan absorber más fácilmente a la bacteria. Como enzima funciona atacando a los peptidoglicanos, lo que explica su localización en la pared celular de las bacterias, especialmente en las gram positivas. La lisozima hidroliza el enlace glucosídico entre el residuo de ácido N-acetilmurámico NAMA y el carbono 4 (C4) de la N-acetilglucosamina.
Hace esto uniendo la molécula de peptidoglicano en el sitio activo, una prominente hendidura entre sus dos dominios, provocando que la molécula substrato adopte una conformación muy tensa, similar a la de un estado de transición. Según el mecanismo de Phillips, la lizosima se une a un hexasacárido deformando el cuarto azúcar (el anillo D) que adopta una conformación de media silla. En este estado de tensión el enlace glucosídico es fácilmente roto.
Se ha descubierto que el ácido glutámico 35 (Glu35) y el ácido aspártico 52 (Asp52) son indispensables para la actividad de esta enzima. El Glu35 actúa como donador de protones para el enlace glucosídico, cortando el enlace C-O en el sustrato. El Asp52 actúa como nucleófilo para generar el intermediario enzimático-glucosídico (complejo enzima-sustrato). Luego, este intermediario reacciona con una molécula de agua para volver a dejar intacta a la enzima y liberar el producto de la hidrólisis.
Rol en patologías
Algunas formas de amiloidosis tienen como causa la mutación del gen de la lisozima, lo que conduce a la acumulación de este enzima en varios tejidos.[1]
Historia
Alexander Fleming (1881-1955), quien descubrió la penicilina, describió a la lisozima en 1922.[2] Su estructura fue descripta por David Chilton Phillips (1924-1999) en 1965, cuando consiguió una imagen con una resolución de 2 angstrom (200pm).[3][4] Este trabajo llevó a Phillips a proveer una explicación acerca de cómo las enzimas aceleran las reacciones en términos de su estructura física. Howard Florey (1898-1968) y Ernst B. Chain (1906-1979) también investigaron las lisozimas. Aunque nunca lograron demasiados progresos en este campo, aportaron al desarrollo de la penicilina, un área en la que Fleming no tuvo éxito.[5]
Referencias
- ↑ OMIM 105200
- ↑ Fleming A. On a remarkable bacteriolytic element found in tissues and secretions. Proc Roy Soc Ser B 1922;93:306-17
- ↑ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Ångstrom resolution. Nature, 206, 757-61
- ↑ Johnson LN, Phillips DC. Structure of some crystalline lysozyme-inhibitor complexes determined by X-ray analysis at 6 Ångstrom resolution. Nature, 206, 761-3.
- ↑ Vocadlo, D. J.; Davies, G. J.; Laine, R.; Withers, S. G. Nature 2001, 412, 835.
