Diferencia entre revisiones de «Sulfato»
Sin resumen de edición |
m Revertidos los cambios de 189.234.7.68 a la última edición de Diegusjaimes |
||
| Línea 1: | Línea 1: | ||
[[Archivo:Sulfate-ion-2D-dimensions.png|thumb|Estructura del [[ión]] sulfato.]] |
[[Archivo:Sulfate-ion-2D-dimensions.png|thumb|Estructura del [[ión]] sulfato.]] |
||
Los |
Los '''sulfatos''' son las [[sal (química)|sales]] o los [[éster]]es del [[ácido sulfúrico]]. Contienen como unidad común un átomo de [[azufre]] en el centro de un tetraedro formado por cuatro átomos de oxígeno. |
||
== Los sulfatos inorgánicos == |
== Los sulfatos inorgánicos == |
||
Revisión del 00:52 14 ene 2010
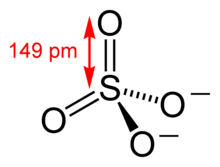
Los sulfatos son las sales o los ésteres del ácido sulfúrico. Contienen como unidad común un átomo de azufre en el centro de un tetraedro formado por cuatro átomos de oxígeno.
Los sulfatos inorgánicos
Los sulfatos inorgánicos son las sales del ácido sulfúrico. En la naturaleza se encuentran en forma de yeso, o aljez, (sulfato de calcio dihidratado CaSO4 · 2 H2O), baritina (sulfato de bario) o sulfato de sodio (Na2SO4). Por oxidación se forma de los sulfuros de muchos elementos cuando estos entren en contacto con el oxígeno del aire.
Síntesis
La mayor parte de los sulfatos se genera a partir de una base y del ácido sulfúrico o por reacción del ácido sulfúrico con el metal esto puede generar trasplantes en el átomo de oxigeno.
Aplicaciones
Las aplicaciones de los sulfatos suelen variar enormemente según el metal al que están unidos. Así el sulfato sódico, por ejemplo, se utiliza en la fabricación del vidrio, como aditivo en los detergentes, etc.; el sulfato de cobre se aprovecha en la fabricación de la viscosa según un determinado proceso.
Yeso y barita se utilizan en la construcción y como aditivos en la fabricación de papel y cartulina. El sulfato de bario también se utiliza en medicina para realizar radiografías de contraste.
Los sulfatos son parte esencial de unas sales dobles como los alumbres de fórmula general AB(SO4)2 · 12 H2O, siendo A y B cationes con carga +1 y +3 respectivamente. La más conocida es la alumbre de sodio formada con sodio y aluminio.
Analítica
Los sulfatos solubles precipitan en presencia de cloruro de bario incluso de solución ácida en forma de sulfato de bario (BaSO4) como sólido blanco. Si al mismo tiempo hay permanganato presente este puede ser incluido en el precipitado dándole un color ligeramente rosáceo.
Con sodio metálico es reducido al sulfuro (Cuidado: reacción muy violenta) y puede ser determinado como tal.
Los sulfatos orgánicos
Los sulfatos orgánicos son ésteres del ácido sulfúrico con la fórmula genérica R–O–SO2–O–R'. Se pueden formar directamente del alcohol correspondiente y del ácido sulfúrico o del trióxido de azufre o a partir del alcohol y el cloruro de sulfurilo (Cl2SO2) en presencia de unas base.
Se trata de sustancias probablemente cancerígenas.
El sulfato orgánico más conocido es el sulfato de dimetilo (H3CO)2SO2 que se utiliza en algunas reacciones de metilación.
