Diferencia entre revisiones de «ARN interferente»
/*moises figuero/* |
m Revertidos los cambios de 190.20.42.44 a la última edición de Muro Bot |
||
| Línea 8: | Línea 8: | ||
[[Archivo:Mechanism of RNA interference.jpg|thumb|300px|right|Mecanismo de ribointerferencia]] |
[[Archivo:Mechanism of RNA interference.jpg|thumb|300px|right|Mecanismo de ribointerferencia]] |
||
ii son puros longis los qe leen estojkajkakjajkak |
|||
=== siRNA === |
=== siRNA === |
||
{{AP|siRNA}} |
{{AP|siRNA}} |
||
| Línea 17: | Línea 17: | ||
=== miRNA === |
=== miRNA === |
||
{{AP|microARN}} |
{{AP|microARN}} |
||
Los microARN (en inglés, ''micro-RNA'' o ''miRNA'') son pequeños ARN interferentes que se generan a partir de precursores específicos codificados en el genoma, que al transcribirse se pliegan en horquillas (''hairpins'') intramoleculares que contienen segmentos de complementariedad imperfecta. El procesamiento de los precursores ocurre generalmente en dos etapas, catalizado por dos enzimas, Drosha en el núcleo y Dicer en el citoplasma. Una de las hebras del miRNA (la hebra 'antisentido'), como ocurre con los siRNA, se incorpora a un complejo similar al RISC. Dependiendo del grado de complementariedad del miRNA con el ARNm, los miRNA pueden bien inhibir la traducción del ARNm o bien inducir su degradación. Sin embargo, a diferencia con la vía de los siRNA, la degradación de ARNm mediada por miRNA se inicia con la eliminación enzimática de la cola de poli(A) del ARNm. |
Los microARN (en inglés, ''micro-RNA'' o ''miRNA'') son pequeños ARN interferentes que se generan a partir de precursores específicos codificados en el genoma, que al transcribirse se pliegan en horquillas (''hairpins'') intramoleculares que contienen segmentos de complementariedad imperfecta. El procesamiento de los precursores ocurre generalmente en dos etapas, catalizado por dos enzimas, Drosha en el núcleo y Dicer en el citoplasma. Una de las hebras del miRNA (la hebra 'antisentido'), como ocurre con los siRNA, se incorpora a un complejo similar al RISC. Dependiendo del grado de complementariedad del miRNA con el ARNm, los miRNA pueden bien inhibir la traducción del ARNm o bien inducir su degradación. Sin embargo, a diferencia con la vía de los siRNA, la degradación de ARNm mediada por miRNA se inicia con la eliminación enzimática de la cola de poli(A) del ARNm. |
||
| Línea 26: | Línea 26: | ||
{{AP|ARN asociados a Piwi}} |
{{AP|ARN asociados a Piwi}} |
||
(''Piwi-interacting RNAs'', ARN asociados a Piwi<ref name="Hartig2007"> {{cita publicación | autor = Hartig |
(''Piwi-interacting RNAs'', ARN asociados a Piwi<ref name="Hartig2007"> {{cita publicación | autor = Hartig JV, Tomari Y, Förstemann K. | título = piRNAs--the ancient hunters of genome invaders.| año = 2007 | publicación = Genes Dev. | volumen = 21 | número = 14 | id = 1707-13 }} [http://genesdev.cshlp.org/cgi/content/full/21/14/1707] </ref>): se generan a partir de precursores largos monocatenarios, en un proceso que es independiente de Drosha y Dicer. Estos ARN pequeños se asocian con una subfamilia de las proteínas 'Argonauta' denominada proteínas Piwi. Se han identificado decenas de miles de piRNA, pero su función es desconocida (2008). Sin embargo, se sabe que conjuntamente con las proteínas Piwi, son necesarios para el desarrollo de las células de la línea germinal. |
||
== Variación entre organismos == |
== Variación entre organismos == |
||
Revisión del 23:13 29 abr 2009
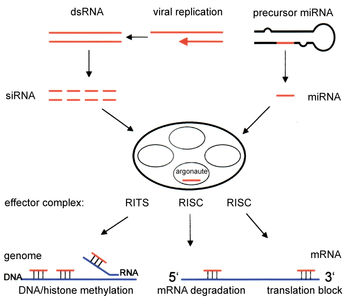
El ARN interferente, abreviado ARNi (del inglés interfering RNA, iRNA), es una molécula de ARN que suprime la expresión de genes específicos mediante mecanismos conocidos globalmente como ribointerferencia o interferencia por ARN (RNA interference, RNAi).
Tipos de ARN interferente
Los ARN interferentes son moléculas pequeñas (de 20 a 25 nucléotidos) que se generan por fragmentación de precursores más largos. Se pueden clasificar en tres grandes grupos:[2]

siRNA
El acrónimo siRNA proviene el inglés small interfering RNA: en español, ARN interferente pequeño o ARNip. Son moléculas de ARN bicatenario perfectamente complementarias de aproximadamente 20 o 21 nucleótidos (nt) con 2 nucleótidos desemparejados en cada extremo 3'. Cada hebra de ARN tiene un grupo fosfato 5' y un grupo hidroxilo (-OH) 3'. Esta estructura proviene del procesamiento llevado a cabo por Dicer, una enzima que corta moléculas largas de ARN bicatenario (dsRNA, double stranded RNA) en varios siRNA.[3] Una de las hebras del siRNA (la hebra 'antisentido') se ensambla en un complejo proteico denominado RISC (RNA-induced silencing complex), que utiliza la hebra de siRNA como guía para identificar el ARN mensajero complementario. El complejo RISC cataliza el corte del ARNm complementario en dos mitades, que son degradadas por la maquinaria celular, bloqueando así la expresión del gen. Los siRNA pueden ser también introducidos de forma exógena en las células utilizando métodos de transfección basándose en la secuencia complementaria de un gen en particular, con la finalidad de reducir significativamente su expresión.
Para ampliar información, puede consultarse la página sobre los siRNA.
miRNA
Los microARN (en inglés, micro-RNA o miRNA) son pequeños ARN interferentes que se generan a partir de precursores específicos codificados en el genoma, que al transcribirse se pliegan en horquillas (hairpins) intramoleculares que contienen segmentos de complementariedad imperfecta. El procesamiento de los precursores ocurre generalmente en dos etapas, catalizado por dos enzimas, Drosha en el núcleo y Dicer en el citoplasma. Una de las hebras del miRNA (la hebra 'antisentido'), como ocurre con los siRNA, se incorpora a un complejo similar al RISC. Dependiendo del grado de complementariedad del miRNA con el ARNm, los miRNA pueden bien inhibir la traducción del ARNm o bien inducir su degradación. Sin embargo, a diferencia con la vía de los siRNA, la degradación de ARNm mediada por miRNA se inicia con la eliminación enzimática de la cola de poli(A) del ARNm.
Para ampliar información, puede consultarse la página sobre los miRNA.
piRNA
(Piwi-interacting RNAs, ARN asociados a Piwi[4]): se generan a partir de precursores largos monocatenarios, en un proceso que es independiente de Drosha y Dicer. Estos ARN pequeños se asocian con una subfamilia de las proteínas 'Argonauta' denominada proteínas Piwi. Se han identificado decenas de miles de piRNA, pero su función es desconocida (2008). Sin embargo, se sabe que conjuntamente con las proteínas Piwi, son necesarios para el desarrollo de las células de la línea germinal.
Variación entre organismos
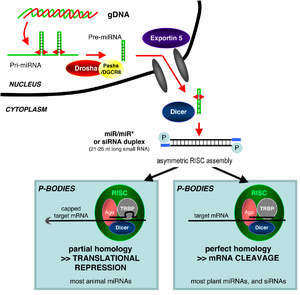
Los organismos varían en su capacidad de aceptar RNA bicatenario extraño y utilizarlo en la ruta de ribointerferencia. Los efectos de la ribointerferencia pueden ser sistémicos y heredables en plantas y C. elegans, pero no en Drosophila o mamíferos. En plantas, se piensa que la ribointerferencia se propaga por la transferencia de siRNA entre las células, a través de los plasmodesmos (canales en las paredes celulares que permiten la comunicación y el transporte). La heredabilidad procede de la metilación de los promotores dirigida por RNA interferente; el nuevo patrón de metilación se copia en cada nueva generación de la célula.[6]
Entre plantas y animales se observa una distinción general amplia en la utilización de los miRNA endógenos; en plantas, los miRNA son normalmente perfectamente (o casi) complementarios a su gen diana, e inducen el corte directo del ARN a través de RISC, mientras que los miRNA de animales tienden a ser más divergentes en la secuencia e inducen represión a nivel de la traducción del ARNm diana.[5]
Algunos protozoos eucariotas tales como Leishmania major y Trypanosoma cruzi carecen completamente de la ruta de ribointerferencia.[7][8] La mayoría de los componentes también están ausentes en algunos hongos, notablemente en el organismo modelo Saccharomyces cerevisiae.[9] El hecho de que algunos ascomicetos y basidiomicetos carezcan de rutas de ribointerferencia indica que algunas proteínas requeridas para la ribointerferencia se han perdido de forma independiente en muchos linajes de hongos, posiblemente debido a la evolución de una nueva ruta con función similar, o a la falta de ventaja selectiva en ciertos nichos.[10]
Evolución
A partir de estudios filogenéticos computacionales basados en el principio de máxima parsimonia, el ancestro común más reciente de todos los eucariotas probablemente ya poseía una ruta primitiva de ribointerferencia; se piensa que la ausencia de la ruta en ciertos eucariotas es una característica derivada.[11] Este sistema de ribointerferencia ancestral probablemente contenía una proteína similar a Dicer, una proteína Argonauta, una proteína PIWI, y una ARN polimerasa dependiente de ARN (RdRP) que podría haber realizado otras funciones celulares. Un estudio a gran escala de genómica comparativa también indica que el grupo corona (un grupo monofilético vivo, o clado, que consiste del último ascendente común de todos los ejemplares vivos, más todos sus descendientes) ya poseía estos componentes, que en aquel momento podrían haber tenido asociaciones funcionales más estrechas con los sistemas generales de degradación del ARN como el exosoma.[12] Este estudio también sugiere que la familia de proteínas "Argonauta" de unión a ARN, que es común entre los eucariotas, la mayoría de los Archaea, y al menos algunas bacterias (tales como Aquifex aeolicus), es homóloga y originalmente derivada de los componentes del sistema de iniciación de la traducción.
Se piensa que la función ancestral del sistema de ribointerferencia es la defensa inmune contra elementos genéticos exógenos tales como transposones y genomas virales.[11][13] Algunas funciones relacionadas, como la modificación de histonas, podrían haber estado ya presentes en el ancestro de los modernos eucariotas, aunque parece que otras funciones como la regulación del desarrollo por los miRNA habrían aparecido posteriormente.[11]
Los genes de la ribointerferencia, como componentes del sistema inmune antiviral en muchos eucariotas, están implicados en una "batalla evolutiva" con los genes virales. Algunos virus han desarrollado mecanismos para suprimir la respuesta de ribointerferencia de sus células huésped, un efecto muy aparente sobre todo en los virus de plantas.[14] Estudios de las tasas evolutivas en Drosophila muestran que los genes de la ruta de ribointerferencia están sometidas una fuerte selección direccional y están entre los genes con una tasa de evolución más rápida del genoma de Drosophila.[15]
Ribointerferencia y pseudogenes
En 2008, varios estudios en moscas[16][17][18][19] y en ratones,[20][21] proporcionan nueva información: en estos estudios, se sugiere una conexión entre ribointerferencia y pseudogenes que hace más difusa la distinción "tradicional" en tres clases de pequeños ARN: siRNA, miRNA y piRNA (ver un resumen en Sasidharan et al., Nature 2008[22]).
La definición clásica de pseudogén es un elemento genético heredable que es similar a un gen, pero que es afuncional. Sin embargo, el término "afuncional" es ambigüo: ¿significa que no se transcribe, que no se traduce o que no está bajo el control de un promotor?. Los pseudogenes son similares a genes que codifican proteínas porque normalmente se han generado por copia de un gen ancestral, bien por duplicación incorrecta o por retrotransposición (en la que el ADN es primero transcrito en ARN y luego "retro-transcrito" en ADN e insertado en otro lugar del genoma). Como el proceso de copiado no genera una proteína funcional, los pseudogenes se identifican por 'disfunciones' en su secuencia, como cambios de marco de lectura (frameshifts), o paradas prematuras. Son interesantes porque constituyen un resto de antiguas moléculas codificadas por el genoma.
Los pseudogenes son por tanto fósiles de genes de antiguas proteínas, y aunque muchos de ellos se transcriben, se han considerado como ADN basura, que consituye en su conjunto alrededor del 99% del genoma en humanos. Una gran parte del ADN "basura" (junk DNA) está constituida precisamente por pseudogenes; esta abundancia de pseudogenes en el genoma (decenas de miles en humanos, casi la misma cantidad de genes que codifican proteínas) hace improbable que sean afuncionales. Además, una gran parte de ellos están sometidos a un proceso de selección natural.[23] Una de las funciones propuesta para los pseudogenes es la regulación génica, y el mecanismo propuesto para realizar esta función es el ARN interferente.
Los seis manuscritos indicados anteriormente describen el descubrimiento de pequeñas moléculas de siRNA naturales en moscas y en ratones, algunas de las cuales son potencialmente transcritas a partir de pseudogenes.
Endo-siRNA
En general, el proceso de ribointerferencia implica varios tipos de pequeñas secuencias de ARN "guía" que regulan los niveles de la proteína diana al direccionar para su degradación el ARNm de ésta. En los seis estudios indicados, algunos siRNA procedentes de pseudogenes generan dos de las cuatro categorías de siRNA naturales (o endo-siRNA):
- la primera categoría de endo-siRNA media el silenciamiento de transposones, que es una característica de los piRNA. A diferencia de los piRNA, que constan de 24 a 30 nucleótidos y utilizan Piwi como proteína efectora, los endo-siRNA de primera categoría tienen de 21 a 22 nt, y utlilizan Ago2.
- la segunda categoría se genera mediante la transcripcion bidireccional de loci parcialmente superpuestos en hebras opuestas de ADN.[16][19] Se han identificado unos 1000 endo-siRNA de este tipo en moscas, y estudios en ratones muestran algunos ejemplos.[20][21] Los genes diana de esta categoría de endo-siRNA están relacionados con funciones de los ácidos nucleicos, como actividad nucleasa o unión a factores de transcripción.
- la tercera categoría de endo-siRNA se ha detectado sólo en ratones[20][21] y son el producto de la interacción de un ARNm transcrito a partir de un gen que codifica una proteína y un transcrito anti-sentido a partir del pseudogén correspondiente, que puede estar localizado lejos del gen codificante, en el mismo cromosoma o en otro.
- los endo-siRNA de la cuarta categoría están muy relacionados con los de la tercera: se generan a partir de secuencias en forma de horquilla (hairpin), que en ratón pueden proceder de las estructuras en repetición invertida de los pseudogenes. En este caso, el pseudogén también regula su gen codificante, pero el precursor de ARN bicatenario procede de la transcripción de una secuencia con repeticiones invertidas que dan lugar a una horquilla.
Los manuscritos indicados muestran que las proteínas de ratón afectadas por las categorías tercera y cuarta de endo-siRNA están generalmente implicadas en funciones específicas - como la regulación de la dinámica del citoesqueleto - lo que indica que la regulación subyacente mediada por pseudogenes ha sido seleccionada expresamente para ello, y no generada simplemente por el apareamiento al azar de tránscritos de genes y pseudogenes.
También se han encontrado precursores en horquilla de endo-siRNA en moscas, pero hay pocas evidencias que los relacionen con pseudogenes. La mayor parte de los endo-siRNA asociados con pseudogenes, por tanto, se han detectado en ratones. Una posible explicación es que el genoma de ratón contiene muchos más pseudogenes que el genoma de la mosca.[24]
Sin embargo, para demostrar de forma concluyente la actividad de los pseudogenes, son necesarios más experimentos (por ejemplo, eliminar un pseudogén y demostrar el efecto sobre el gen codificante potencialmente regulado por el pseudogén).
Como se indicaba al principio, además de conectar pseudogenes y ribointerferencia, estos estudios también hacen más difusas las diferencias entre los tres tipos "tradicionales" de ARN interferentes (siRNA, miRNA y piRNA), que son distintos en su biogénesis y en sus funciones celulares. Estos estudios indican que los endo-siRNA regulan transposones (como los piRNA), que pueden generarse a partir de estructuras en horquilla (como los miRNA) y que, en moscas, su procesamiento implica un cofactor similar al de los miRNA.
El hecho de que las líneas de separación entre los distintos tipos de ARN interferente sean más difusas, unido a las nuevas conexiones entre pseudogenes y siRNA, tiene interesantes consecuencias evolutivas. En plantas se ha propuesto que las duplicaciones invertidas de un gen codificante podrían ser un mecanismo de generación de nuevos miRNA.[25] De esta forma, algunos endo-siRNA codificados por pseudogenes podrían proporcionar una conexión intermedia para comprender la evolución de la regulación génica mediada por miRNA.[26] Aunque especulativa, un estudio reciente del contexto genómico de más de 300 miRNA loci en humanos ha identificado dos en pseudogenes,[27] lo que apoyaría dicha hipótesis.
Véase también
- Ribo-llaves (ribo-switches): son formas de ARN que actúan como llaves "encendido-apagado" de gran precisión.
- ARNnc (ARN no codificante): ARN funcional que no codifica proteínas.
Referencias
- ↑ Hammond SM, Bernstein E, Beach D, Hannon GJ. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature. 2000 Mar 16;404(6775):293-6 [1]
- ↑ Grosshans H, Filipowicz W. Molecular biology: the expanding world of small RNAs. Nature. 2008 Jan 24;451(7177):414-6 [2]
- ↑ Bernstein E, Caudy AA, Hammond SM, Hannon GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature. 2001 Jan 18;409(6818):363-6 [3]
- ↑ Hartig JV, Tomari Y, Förstemann K. (2007). «piRNAs--the ancient hunters of genome invaders.». Genes Dev. 21 (14). 1707-13. [4]
- ↑ a b Saumet A, Lecellier CH (2006). «Anti-viral RNA silencing: do we look like plants?». Retrovirology 3 (3): 3. PMID 16409629. doi:10.1186/1742-4690-3-3.
- ↑ Jones L, Ratcliff F, Baulcombe DC (2001). «RNA-directed transcriptional gene silencing in plants can be inherited independently of the RNA trigger and requires Met1 for maintenance». Current Biology 11 (10): 747-757. doi:10.1016/S0960-9822(01)00226-3.
- ↑ DaRocha W, Otsu K, Teixeira S, Donelson J (2004). «Tests of cytoplasmic RNA interference (RNAi) and construction of a tetracycline-inducible T7 promoter system in Trypanosoma cruzi». Mol Biochem Parasitol 133 (2): 175-86. PMID 14698430. doi:10.1016/j.molbiopara.2003.10.005.
- ↑ Robinson K, Beverley S (2003). «Improvements in transfection efficiency and tests of RNA interference (RNAi) approaches in the protozoan parasite Leishmania». Mol Biochem Parasitol 128 (2): 217-28. PMID 12742588. doi:10.1016/S0166-6851(03)00079-3.
- ↑ L. Aravind, Hidemi Watanabe, David J. Lipman, and Eugene V. Koonin (2000). «Lineage-specific loss and divergence of functionally linked genes in eukaryotes». Proceedings of the National Academy of Sciences 97 (21): 11319-11324. PMID 11016957. doi:10.1073/pnas.200346997.
- ↑ Nakayashiki H, Kadotani N, Mayama S (2006). «Evolution and diversification of RNA silencing proteins in fungi». J Mol Evol 63 (1): 127-35. PMID 16786437. doi:10.1007/s00239-005-0257-2.
- ↑ a b c Cerutti H, Casas-Mollano J (2006). «On the origin and functions of RNA-mediated silencing: from protists to man». Curr Genet 50 (2): 81-99. PMID 16691418. doi:10.1007/s00294-006-0078-x.
- ↑ Anantharaman V, Koonin E, Aravind L (2002). «Comparative genomics and evolution of proteins involved in RNA metabolism». Nucleic Acids Res 30 (7): 1427-64. PMID 11917006. doi:10.1093/nar/30.7.1427.
- ↑ Buchon N, Vaury C (2006). «RNAi: a defensive RNA-silencing against viruses and transposable elements». Heredity 96 (2): 195-202. PMID 16369574. doi:10.1038/sj.hdy.6800789.
- ↑ Lucy A, Guo H, Li W, Ding S (2000). «Suppression of post-transcriptional gene silencing by a plant viral protein localized in the nucleus». EMBO J 19 (7): 1672-80. PMID 10747034. doi:10.1093/emboj/19.7.1672.
- ↑ Obbard D, Jiggins F, Halligan D, Little T (2006). «Natural selection drives extremely rapid evolution in antiviral RNAi genes». Curr Biol 16 (6): 580-5. PMID 16546082. doi:10.1016/j.cub.2006.01.065.
- ↑ a b Czech B, Malone CD, Zhou R, Stark A, Schlingeheyde C, Dus M, Perrimon N, Kellis M, Wohlschlegel JA, Sachidanandam R, Hannon GJ, Brennecke J. An endogenous small interfering RNA pathway in Drosophila.Nature 2008 Jun 5;453(7196):798-802 [5]
- ↑ Ghildiyal M, Seitz H, Horwich MD, Li C, Du T, Lee S, Xu J, Kittler EL, Zapp ML, Weng Z, Zamore PD.Endogenous siRNAs derived from transposons and mRNAs in Drosophila somatic cells.Science 2008 May 23;320(5879):1077-81 [6]
- ↑ Kawamura Y, Saito K, Kin T, Ono Y, Asai K, Sunohara T, Okada TN, Siomi MC, Siomi H.Drosophila endogenous small RNAs bind to Argonaute 2 in somatic cells.Nature 2008 Jun 5;453(7196):793-7 [7]
- ↑ a b Okamura K, Chung WJ, Ruby JG, Guo H, Bartel DP, Lai EC. The Drosophila hairpin RNA pathway generates endogenous short interfering RNAs.Nature 2008 Jun 5;453(7196):803-6 [8]
- ↑ a b c Tam OH, Aravin AA, Stein P, Girard A, Murchison EP, Cheloufi S, Hodges E, Anger M, Sachidanandam R, Schultz RM, Hannon GJ.Pseudogene-derived small interfering RNAs regulate gene expression in mouse oocytes.Nature 2008 May 22;453(7194):534-8 [9]
- ↑ a b c Watanabe T, Totoki Y, Toyoda A, Kaneda M, Kuramochi-Miyagawa S, Obata Y, Chiba H, Kohara Y, Kono T, Nakano T, Surani MA, Sakaki Y, Sasaki H.Endogenous siRNAs from naturally formed dsRNAs regulate transcripts in mouse oocytes.Nature 2008 May 22;453(7194):539-43 [10]
- ↑ Sasidharan R, Gerstein M. Protein fossils live on as RNA. Nature 2008 June 5;453(7196):729-31 [11]
- ↑ Zheng D, Frankish A, Baertsch R, Kapranov P, Reymond A, Choo SW, Lu Y, Denoeud F, Antonarakis SE, Snyder M, Ruan Y, Wei CL, Gingeras TR, Guigó R, Harrow J, Gerstein MB. Pseudogenes in the ENCODE regions: consensus annotation, analysis of transcription, and evolution.Genome Res. 2007 Jun;17(6):839-51 [12]
- ↑ Identification of pseudogenes in the Drosophila melanogaster genome.Nucleic Acids Res. 2003 Feb 1;31(3):1033-7 [13]
- ↑ Allen E, Xie Z, Gustafson AM, Sung GH, Spatafora JW, Carrington JC.Evolution of microRNA genes by inverted duplication of target gene sequences in Arabidopsis thaliana.Nature Genet. 2004 Dec;36(12):1282-90 [14]
- ↑ Chapman EJ, Carrington JC. Specialization and evolution of endogenous small RNA pathways.Nature Rev.Genet. 2007 Nov;8(11):884-96 [15]
- ↑ Devor EJ.Primate microRNAs miR-220 and miR-492 lie within processed pseudogenes.J.Hered.2006 Mar-Apr;97(2):186-90 [16]
Enlaces externos
 Wikiversidad alberga proyectos de aprendizaje sobre ARN interferente.
Wikiversidad alberga proyectos de aprendizaje sobre ARN interferente.- Animación del proceso de ribointerferencia (en inglés), de Nature
- NOVA scienceNOW explains RNAi – Un video de 15 minutos (en inglés) del magacín Nova que se emitió en PBS, July 26, 2005
- Plantilla:PLoSlink
- Silencing Genomes Experimentos de ribointerferencia y bioinformática en C. elegans para alumnos. Del Dolan DNA Learning Center of Cold Spring Harbor Laboratory (en inglés).
- RNAi screens in C. elegans in a 96-well liquid format and their application to the systematic identification of genetic interactions (a protocol)
- 2 American ‘Worm People’ Win Nobel for RNA Work, from NY Times
- Nano RNA Delivery - Novel delivery agents could mean a more targeted way to turn off disease genes, Technology Review, April 29, 2008
