Catión
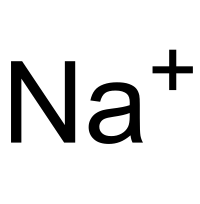
Un catión es un ión (o sea átomo o molécula) con carga eléctrica positiva, es decir, que ha perdido electrones. Los cationes se describen con un estado de oxidación positivo. En términos químicos, es cuando un átomo neutro pierde uno o más electrones de su dotación original, éste fenómeno se conoce como ionización.
Ión o ion: En química, se define al ión, del griego ión (ἰών), participio presente de ienai "ir", de ahí "el que va", como una especie química, ya sea un átomo o una molécula, cargada eléctricamente.
Las sales típicamente están formadas por cationes y aniones (aunque el enlace nunca es puramente iónico, siempre hay una contribución covalente).
También los cationes están presentes en el organismo en elementos tales como el sodio (Na) y el potasio (K) en forma de sales ionizadas.
Ejemplo: El catión K+ es un K que perdió un electrón para quedar isoelectrónico con el argón. El Mg2+ es un Mg que perdió 2 electrones para quedar isoelectrónico con el neón
Cationes frecuentes
| Nombre IUPAC | Símbolo | Nombre tradicional | |
|---|---|---|---|
| Cationes simples | |||
| Catión aluminio | Al3+ | Catión aluminio | |
| Catión bario | Ba2+ | Catión bario | |
| Catión berilio | Be2+ | Catión berilio | |
| Catión cesio | Cs+ | Catión cesio | |
| Catión calcio | Ca2+ | Catión calcio | |
| Catión cromo (II) | Cr2+ | Catión cromoso | |
| Catión cromo (III) | Cr3+ | Catión crómico | |
| Catión cromo (VI) | Cr6+ | Catión percrómico | |
| Catión cobalto (II) | Co2+ | Catión cobaltoso | |
| Catióncobalto (III) | Co3+ | Catión cobáltico | |
| Catión cobre (I) | Cu+ | Catión cuproso | |
| Catión cobre (II) | Cu2+ | Catión cúprico | |
| Catión galio | Ga3+ | Catión galio | |
| Catión helio | He2+ | (partícula α) | |
| Catión hidrógeno | H+ | Catión hidrógeno (Protón) | |
| Catión hierro (II) | Fe2+ | Catión ferroso | |
| Catión hierro (III) | Fe3+ | Catión férrico | |
| Catión plomo (II) | Pb2+ | Catión plumboso | |
| Catión plomo (IV) | Pb4+ | Catión plúmbico | |
| Catión litio | Li+ | Catión litio | |
| Catión magnesio | Mg2+ | Catión magnesio | |
| Catión manganeso (II) | Mn2+ | Catión hipomanganoso | |
| Catión manganeso (III) | Mn3+ | Catión manganoso | |
| Catión manganeso (IV) | Mn4+ | Catión mangánico | |
| Catión manganeso (VII) | Mn7+ | Catión permangánico | |
| Catión mercurio (II) | Hg2+ | Catión mercúrico | |
| Catión níquel (II) | Ni2+ | Catión niqueloso | |
| Catión níquel (III) | Ni3+ | Catión niquélico | |
| Catión potasio | K+ | Catión potasio | |
| Catión plata | Ag+ | Catión argéntico | |
| Catión sodio | Na+ | Catión sodio | |
| Catión estroncio | Sr2+ | Catión estroncio | |
| Catión estaño (II) | Sn2+ | Catión estannoso | |
| Catión estaño (IV) | Sn4+ | Catión estánnico | |
| Catión zinc | Zn2+ | Catión zinc | |
| Cationes poliatómicos | |||
| Catión amonio | NH4+ | ||
| Catión hidronio | H3O+ | ||
| Catión nitronio | NO2+ | ||
| Catión mercurio (I) | Hg22+ | Catión mercurioso | |
Desde la publicación en 2005 del "Libro Rojo" de la IUPAC de recomendaciones para la nomenclatura y formulación inorgánicas, la nomenclatura tradicional o antigua con las terminaciones "-oso" e "-ico" es desaconsejada salvo para los oxoácidos.
Cationes en procesos biológicos
Los cationes juegan muchos papeles en los procesos biológicos. Los gradientes de concentración de diversos cationes (Na+, K+, etc) a través de las membranas celulares mantienen diferentes potenciales electroquímicos que son empleados para transportar diferentes moléculas orgánicas al interior de las células por difusión facilitada.[1] También promueven la contracción muscular, la transmisión de impulsos nerviosos, etc. Además, los cationes metálicos están presentes en los sitios activos de muchas enzimas formando parte de funciones catalíticas, etc.
Cationes en medicina
En medicina se emplean complejos de cationes paramagnéticos como el Gd3+ como agentes de contraste en RMI (resonancia magnética de imágenes) de tejidos blandos.[2] También se emplea el cisplatino como medicamento contra el cáncer debido a su coordinación al DNA impidiendo su replicación y, por tanto, impidiendo el crecimiento de células tumorales que son las de mayor tasa de crecimiento.[3]
Referencias
- ↑ David L. Nelson y Michael M. Cox, "Lehninger. Principios de bioquímica" Editorial Omega. Quinta edición.
- ↑ Lentschig, MG; Reimer, P; Rausch-Lentschig, UL; Allkemper, T; Oelerich, M; Laub, G (1998). «Breath-hold gadolinium-enhanced MR angiography of the major vessels at 1.0 T: Dose-response findings and angiographic correlation». Radiology 208 (2): 353-7. PMID 9680558.
- ↑ Stephen Trzaska (20 June 2005). «Cisplatin». C&EN News 83 (25).
