Diferencia entre revisiones de «Fisetina»
nueva edición |
(Sin diferencias)
|
Revisión del 13:01 9 ene 2015
| Fisetina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 2-(3,4-dihydroxyphenyl)-3,7-dihydroxychromen-4-one | ||
| General | ||
| Otros nombres |
Cotinin (not to be confused with Cotinine) 5-Deoxyquercetin Superfustel Fisetholz Fietin Fustel Fustet Viset Junger fustik | |
| Fórmula estructural |
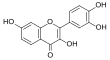 | |
| Fórmula molecular | C15H10O6 | |
| Identificadores | ||
| Número CAS | 528-48-3[1] | |
| ChEBI | 42567 | |
| ChEMBL | 31574 | |
| ChemSpider | 4444933 | |
| DrugBank | DB07795 | |
| PubChem | 5281614 | |
| UNII | OO2ABO9578 | |
| KEGG | C10041 | |
|
O=C1c3c(O/C(=C1/O)c2ccc(O)c(O)c2)cc(O)cc3
| ||
| Propiedades físicas | ||
| Densidad | 1,688 kg/m³; 0,001688 g/cm³ | |
| Masa molar | 286,2363 g/mol | |
| Punto de fusión | 330 °C (603 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Fisetina (3, 7, 3′, 4′-tetrahydroxyflavona) es un flavonol, una sustancia química estructuralmente distinta que pertenece a los flavonoides grupo de polifenoles. Se puede encontrar en muchas plantas, donde sirve como un agente colorante. También se encuentra en muchas frutas y verduras, como las fresas, manzanas, caquis, cebollas y pepinos.[2] Su fórmula química fue descrita por primera vez por el químico austríaco Josef Herzig en 1891.[3]
Fuentes biológicas
Fisetina se puede encontrar en una amplia variedad de plantas. Se encuentra en las eudicotiledóneas, tales como árboles y arbustos en la familia Fabaceae, como las acacias Acacia greggii[4] y Acacia berlandieri,[4] (Butea frondosa), (Gleditsia triacanthos), miembros de la familia Anacardiaceae tales como Quebracho colorado y especies del género Rhus, que contiene los zumaques.[5] Junto con miricetina, fisetina proporciona el color del colorante amarillo tradicional, que se extrajo de Rhus cotinus. Muchas frutas y verduras también contienen fisetina,[6] incluyendo fresas[7][8] manzanas,[8] y las uvas.[9] fisetina puede ser extraído de la fruta y de las fuentes de hierbas en jugos, vinos, [10] e infusiones como el té.[11] es también encontraron en monocotiledóneas como las cebollas.[8] También está presente en especies de Pinophyta como el ciprés amarillo ( Callitropsis nootkatensis ).
Propiedades
Diluido en una solución de etóxido de sodio, fisetina tiene una fluorescencia de color verde oscuro.
Efectos biológicos
Fisetina es ligeramente tóxica y potencialmente mutagénica. Sin embargo, reduce la toxicidad de las aflatoxinas.
Las aplicaciones médicas
Fisetina es un potente activador de sirtuin[12]. Por lo tanto, es un potente mimética de la restricción calórica , actuando así en contra de los efectos del envejecimiento.
Un estudio de P. Maher et al. muestra que fisetina tiene también un efecto beneficioso sobre la memoria a largo plazo.[13]
Un nuevo estudio realizado por P. Maher et al. en ratones Akita (genéticamente predispuestos a la diabetes ) muestran que una dieta rica en fresas (una fruta rica en fisetina) reduce los síntomas de la diabetes y está relacionado con la inflamación del cáncer.[14]
Referencias
- ↑ Número CAS
- ↑ Sahu, Bidya Dhar; Kalvala, Anil Kumar; Koneru, Meghana; Kumar, Jerald Mahesh; Kuncha, Madhusudana; Rachamalla, Shyam Sunder; Sistla, Ramakrishna (September 3, 2014). «Ameliorative Effect of Fisetin on Cisplatin-Induced Nephrotoxicity in Rats via Modulation of NF-κB Activation and Antioxidant Defence». PLoS One 9 (9). doi:10.1371/journal.pone.0105070.
- ↑ Herzig, J. (1891). «Studien über Quercetin und seine Derivate, VII. Abhandlung» [Studies on Quercetin and its Derivatives, Treatise VII]. Monatshefte für Chemie (en german) 12 (1): 177-90. doi:10.1007/BF01538594.
- ↑ a b Forbes TDA, Clement BA. «Chemistry of Acacia's from South Texas» (PDF). Texas A&M Agricultural Research and Extension Center at. Consultado el 14 de abril de 2010.
- ↑ Gábor, M.; Eperjessy, E. (1966). «Antibacterial Effect of Fisetin and Fisetinidin». Nature 212 (5067): 1273. PMID 21090477. doi:10.1038/2121273a0.
- ↑ Fiorani, M.; Accorsi, A. (2005). "Dietary flavonoids as intracellular substrates for an erythrocyte trans-plasma membrane oxidoreductase activity". The British journal of nutrition 94 (3): 338–345. doi:10.1079/bjn20051504. PMID 16176603.
- ↑ Maher, Pamela; Dargusch, Richard; Ehren, Jennifer L.; Okada, Shinichi; Sharma, Kumar; Schubert, David (2011). «Fisetin Lowers Methylglyoxal Dependent Protein Glycation and Limits the Complications of Diabetes». En Deli, Maria A., ed. PLoS ONE 6 (6): e21226. PMC 3124487. PMID 21738623. doi:10.1371/journal.pone.0021226. Resumen divulgativo – ScienceDaily (June 28, 2011).
- ↑ a b c Arai, Y.; Watanabe, S.; Kimira, M.; Shimoi, K.; Mochizuki, R.; Kinae, N. (2000). "Dietary intakes of flavonols, flavones and isoflavones by Japanese women and the inverse correlation between quercetin intake and plasma LDL cholesterol concentration". The Journal of nutrition 130 (9): 2243–2250. PMID 10958819.
- ↑ Arai, Y.; Watanabe, S.; Kimira, M.; Shimoi, K.; Mochizuki, R.; Kinae, N. (2000). "Dietary intakes of flavonols, flavones and isoflavones by Japanese women and the inverse correlation between quercetin intake and plasma LDL cholesterol concentration". The Journal of nutrition 130 (9): 2243–2250. PMID 10958819.
- ↑ De Santi, C.; Pietrabissa, A.; Mosca, F.; Pacifici, G. M. (2002). "Methylation of quercetin and fisetin, flavonoids widely distributed in edible vegetables, fruits and wine, by human liver". International journal of clinical pharmacology and therapeutics 40 (5): 207–212. PMID 12051572.
- ↑ Viñas, P.; Martínez-Castillo, N.; Campillo, N.; Hernández-Córdoba, M. (2011). "Directly suspended droplet microextraction with in injection-port derivatization coupled to gas chromatography–mass spectrometry for the analysis of polyphenols in herbal infusions, fruits and functional foods". Journal of Chromatography A 1218 (5): 639–646. doi:10.1016/j.chroma.2010.12.026. PMID 21185565.
- ↑ David A. Sinclair et al. Descubra tres clases de moléculas que activen sirtuinas (Incluyendo Resveratrol)
- ↑ P. Maher et al.: “Flavonoid fisetin promotes ERK-dependent long-term potentiation and enhances memory”. Proceedings of the National Academy of Sciences of the United States of America 103 (44) (2006), pp. 16568-16573. PMID 17050681
- ↑ Fisetin Lowers Methylglyoxal Dependent Protein Glycation and Limits the Complications of Diabetes, P. Maher & al., 2011
Enlaces externos
- Esta obra contiene una traducción derivada de «Fisetin» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
