Yodación de hidrazonas de Barton
La yodación de hidrazona es una reacción orgánica en la que una hidrazona se convierte en yoduro de vinilo por reacción de yodo y una base no nucleófila como DBU.[1][2] La reacción fue reportada por primera vez por Derek Barton en 1962.
La reacción tiene raíces más tempranas con el descubrimiento de 1911 por Wieland y Roseeu a partir de la reacción de las hidrazonas con yodo elemental (sin base), la cual da como resultado el dímero de azina (estructura 2 en el esquema 1).
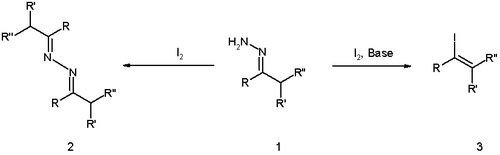
En la publicación original de Barton,[3] la reacción se optimizó mediante el uso de una base fuerte de guanidina, la adición inversa de la hidrazona a una solución de yodo y la eliminación de agua.

Cuando el yodo como electrófilo se reemplaza por bromuros de selenilo aromáticos, se obtienen los seleniuros de vinilo correspondientes:[4]

Mecanismo de reacción de yodación de hidrazona
[editar]El mecanismo de reacción propuesto en la publicación original de Barton se describe a continuación:

La hidrazona es oxidada por yodo en un diazo intermedio. En el siguiente paso, el yodo reacciona como un electrófilo; El desplazamiento de nitrógeno genera un ion yodocarbonio. Cuando el sitio de reacción no está estéricamente impedido, un segundo yoduro puede recombinarse para formar el diyoduro geminal; de lo contrario, una reacción de eliminación conduce al yoduro de vinilo. Cuando hay agua presente, el producto de reacción puede volver a la cetona.
Esta reacción está relacionada con la reacción de Shapiro.
Alcance Un ejemplo de este procedimiento es la reacción de 2,2,6-trimetilciclohexanona a la hidrazona por reacción con hidrazina y trietilamina en etanol a reflujo seguido de la reacción de la hidrazona con yodo en presencia de 2-terc-butil-1,1 , 3,3-tetrametilguanidina (más barata que la DBU) en éter dietílico a temperatura ambiente.[5] Otro ejemplo se puede encontrar en la síntesis total de Danishefsky Taxol.
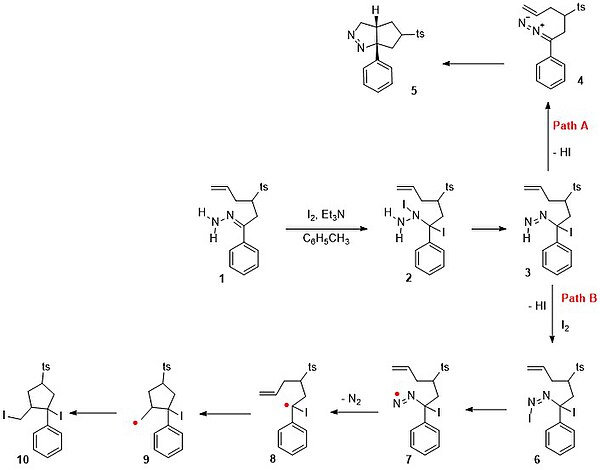
En un estudio[6] se intenta atrapar cualquier intermedio reactivo de esta reacción con un alqueno interno. Cuando la hidrazona 1 en el esquema 5 se hace reaccionar con yodo y trietilamina en tolueno, el producto de reacción esperado no es el diyoduro 10 a través de la ruta B en un mecanismo de radicales libres. Secuencia de reacción a partir de '1' : reacción de adición de halógeno al intermedio di-yoduro '2' seguido de reacción de eliminación con pérdida de Yoduro de hidrógeno a '3' . En la ruta B, otro equivalente de yodo reacciona al doble enlace azo seguido de la pérdida de HI y la formación de '6' . El enlace de nitrógeno a yodo es débil y homólisis da el nitrógeno radical libre '7' . La pérdida de nitrógeno produce especies radicales '8' . La posición de lectura se transfiere al alqueno en '9' que luego se recombina con yoduro a '10' . Tenga en cuenta que en ausencia del alqueno '8' aceptaría un radical yoduro y el geminal di-yoduro pierde HI para formar el yoduro de vinilo. El proceso real que tiene lugar es la ruta A con eliminación de HI al compuesto diazo 4 seguido de una cicloadición 1,3-dipolar de diazoalcano a la pirazolina 5 con un rendimiento del 85%.
Véase también
[editar]Referencias
[editar]- ↑ A new reaction of hydrazones Barton, D. H. R. , R. E. O'Brien and S. Sternhell Journal of the Chemical Society,1962, 470 - 476 doi 10.1039/JR9620000470 Abstract
- ↑ Studies on the oxidation of hydrazones with iodine and with phenylselenenyl bromide in the presence of strong organic bases; an improved procedure for the synthesis of vinyl iodides and phenyl-vinyl selenides Barton, D. H. R.; Bashiardes, G.; Fourrey, J.-L. Tetrahedron 1988, 44, 147 Abstract
- ↑ An improved preparation of vinyl iodides Derek H. R. Barton, George Bashiardes and Jean-Louis Fourrey Tetrahedron Letters Volume 24, Issue 15 , 1983, Pages 1605-1608 Abstract
- ↑ A new synthesis of phenylvinylselenides Derek H. R. Barton, George Bashiardes and Jean-Louis Fourrey Tetrahedron Letters Volume 25, Issue 12 , 1984, Pages 1287-1290 Abstract
- ↑ Preparation and reactions of 2-tert-butyl-1,1,3,3-tetramethylguanidine: 2,2,6-trimethylcyclohexen-1-yl iodide Derek H. R. Barton, Mi Chen, Joseph Cs. Jászberényi, and Dennis K. Taylor Organic Syntheses, Coll. Vol. 9, p.147 (1998); Vol. 74, p.101 (1997) Article Archivado el 17 de noviembre de 2005 en Wayback Machine.
- ↑ Observations on the reaction of hydrazones with iodine: interception of the diazo intermediates Béatrice Quiclet-Sire and Samir Z. Zard Chemical Communications, 2006, 1831 - 1832 Abstract
