Teoría de los orbitales moleculares
En química, la teoría de los orbitales moleculares (TOM), es un método para determinar el enlace químico en el que los electrones no están asignados a enlaces individuales entre átomos, sino que se mueven bajo la influencia de los núcleos de toda la molécula.[1]
En esta teoría, cada molécula tiene un grupo de orbitales moleculares, y se asume que la función de onda ψf del orbital molecular está escrita de manera aproximada como una simple combinación lineal de los n orbitales atómicos constituyentes χi, de acuerdo con la siguiente ecuación:[1]
Los coeficientes cij pueden ser determinados numéricamente por sustitución de esta ecuación en la de Schrödinger y la aplicación del principio variacional. Este método se llama combinación lineal de orbitales atómicos y se utiliza en la química computacional. Una transformación unitaria adicional puede ser aplicada en el sistema para acelerar la convergencia en algunos combinaciones computacionales. La teoría de los orbitales moleculares ha sido vista como competidora de la teoría del enlace de valencia en los años 1930, pero se descubrió después que los dos métodos están íntimamente relacionados y que cuando son extendidos son equivalentes.
La teoría de orbitales moleculares revolucionó el estudio del enlace químico al aproximar los estados de los electrones enlazados -los orbitales moleculares- como combinaciones lineales de orbitales atómicos (LCAO). Estas aproximaciones se realizan aplicando los modelos de Teoría del funcional de la densidad (DFT) o Hartree-Fock (HF) a la ecuación de Schrödinger.
La teoría del orbital molecular y la teoría del enlace de valencia son las teorías fundamentales de la química cuántica.
Visión general de la teoría
[editar]De acuerdo con la teoría de los orbitales moleculares, los enlaces covalentes de las moléculas se forman por solapamiento de orbitales atómicos, de manera que los nuevos orbitales moleculares pertenecen a la molécula entera y no a un solo átomo. Durante la formación de un enlace, los orbitales atómicos se acercan y comienzan a solaparse, liberando energía a medida que el electrón de cada átomo es atraído simultáneamente por la carga positiva del núcleo de los dos átomos. Cuanto mayor sea el solapamiento, mayor será el desprendimiento de energía y, por lo tanto, menor será la energía del orbital molecular. Si el proceso de aproximación de los átomos continúa, los núcleos atómicos pueden llegar a repelerse mutuamente, lo que hace que la energía del sistema aumente. Esto significa que la máxima estabilidad (mínima energía) se alcanza cuando los núcleos se encuentran a una distancia determinada que se conoce como longitud de enlace.[2]
La MOT (Molecular orbital theory) proporciona una perspectiva global y deslocalizada del enlace químico. En la teoría MO, cualquier electrón de una molécula puede encontrarse en cualquier lugar de la molécula, ya que las condiciones cuánticas permiten a los electrones viajar bajo la influencia de un número arbitrariamente grande de núcleos, siempre que se encuentren en estados propios permitidos por ciertas reglas cuánticas. Así, cuando se excitan con la cantidad de energía necesaria mediante luz de alta frecuencia u otros medios, los electrones pueden pasar a orbitales moleculares de mayor energía. Por ejemplo, en el caso simple de una molécula diatómica de hidrógeno, la radiación UV puede hacer que un electrón pase de un orbital de enlace a un orbital de antienlace. Esta promoción debilita el enlace entre los dos átomos de hidrógeno y puede provocar la fotodisociación, es decir, la ruptura de un enlace químico debido a la absorción de luz.
Según la teoría de los orbitales moleculares, el número de orbitales moleculares es igual al número de orbitales atómicos que se solapan. El orbital molecular de menor energía se forma cuando se solapan dos orbitales atómicos que están en fase. Este orbital contiene a los dos electrones y mantiene a los dos átomos unidos, por lo que se denomina orbital molecular enlazante. Sin embargo, se forma otro orbital molecular, que posee una energía mayor que la suma de las energías de los dos orbitales atómicos separados. Este orbital molecular se denomina antienlazante y es destructivo, es decir, si los electrones se encontraran en este orbital, los dos átomos se repelerían.[3] El orbital antienlazante, corresponde en la teoría de Lewis al orbital ocupado por aquellos electrones que no se comparten (llamados "pares no enlazantes" en dicha teoría). Por ejemplo, en el caso de la molécula de oxígeno, existen dos pares enlazantes y cuatro pares no enlazantes. Los pares enlazantes ocupan los orbitales sigma gerade y pi ungerade (en el nivel 2 de energía), los cuales son orbitales enlazantes, y los pares no enlazantes ocupan los orbitales 2s (que no se comparten) y los orbitales pi gerade, dado que tienen menor energía (son más estables) que los sigma gerade.
La teoría de los orbitales moleculares se utiliza para interpretar la espectroscopia ultravioleta-visible (UV-VIS). Los cambios en la estructura electrónica de las moléculas pueden verse por la absorbancia de la luz a longitudes de onda específicas. Se pueden hacer asignaciones a estas señales indicadas por la transición de electrones que se mueven de un orbital de menor energía a otro de mayor energía. El diagrama de orbitales moleculares para el estado final describe la naturaleza electrónica de la molécula en un estado excitado.
Aunque en la teoría MO "algunos" orbitales moleculares pueden contener electrones que están más localizados entre pares específicos de átomos moleculares, "otros" orbitales pueden contener electrones que están repartidos más uniformemente por la molécula. Así, en general, el enlace está mucho más deslocalizado en la teoría MO, lo que la hace más aplicable a moléculas resonantes que tienen órdenes de enlace equivalentes no enteros que la teoría de enlace de valencia (VB). Esto hace que la teoría MO sea más útil para la descripción de sistemas extendidos.
Robert S. Mulliken, que participó activamente en el advenimiento de la teoría de los orbitales moleculares, considera que cada molécula es una unidad autosuficiente. Afirma en su artículo:
...Los intentos de considerar una molécula como formada por unidades atómicas o iónicas específicas unidas por números discretos de electrones de enlace o pares de electrones se consideran más o menos sin sentido, excepto como una aproximación en casos especiales, o como un método de cálculo [...]. Una molécula se considera aquí como un conjunto de núcleos, alrededor de cada uno de los cuales se agrupa una configuración electrónica muy similar a la de un átomo libre en un campo externo, excepto que las partes exteriores de las configuraciones electrónicas que rodean a cada núcleo suelen pertenecer, en parte, conjuntamente a dos o más núcleos....[4]
Un ejemplo es la descripción MO del benceno, C
6H
6, que es un anillo hexagonal aromático de seis átomos de carbono y tres dobles enlaces. En esta molécula, 24 de los 30 electrones de enlace de valencia totales -24 procedentes de átomos de carbono y 6 procedentes de átomos de hidrógeno- se localizan en 12 orbitales de enlace σ (sigma), que se localizan mayoritariamente entre pares de átomos (C-C o C-H), de forma similar a los electrones de la descripción del enlace de valencia. Sin embargo, en el benceno los seis electrones de enlace restantes se encuentran en tres orbitales de enlace molecular π (pi) que están deslocalizados alrededor del anillo. Dos de estos electrones están en un MO que tiene contribuciones orbitales iguales de los seis átomos. Los otros cuatro electrones están en orbitales con nodos verticales en ángulos rectos entre sí. Como en la teoría VB, estos seis electrones π deslocalizados residen en un espacio mayor que existe por encima y por debajo del plano del anillo. Todos los enlaces carbono-carbono del benceno son químicamente equivalentes. En la teoría MO esto es una consecuencia directa del hecho de que los tres orbitales π moleculares se combinan y reparten uniformemente los seis electrones extra entre los seis átomos de carbono.
En moléculas como el metano, CH
4, los ocho electrones de valencia se encuentran en cuatro MOs que se reparten entre los cinco átomos. Es posible transformar los MOs en cuatro orbitales sp3 localizados. Linus Pauling, en 1931, hibridó los orbitales 2s y 2p del carbono para que apuntaran directamente a las funciones base hidrógeno 1s y presentaran un solapamiento máximo. Sin embargo, la descripción de la MO deslocalizada es más apropiada para predecir la energías de ionización y las posiciones de las bandas de absorción espectrales. Cuando el metano se ioniza, se toma un solo electrón de la MO de valencia, que puede provenir del enlace s o de los niveles de enlace p triplemente degenerados, produciendo dos energías de ionización. En comparación, la explicación en la teoría del enlace de valencia es más complicada. Cuando se elimina un electrón de un orbital sp3, se invoca resonancia entre cuatro estructuras de enlace de valencia, cada una de las cuales tiene un enlace de un solo electrón y tres enlaces de dos electrones. Los estados ionizados triplemente degenerados T2 y A1 (CH4+) se producen a partir de diferentes combinaciones lineales de estas cuatro estructuras. La diferencia de energía entre el estado ionizado y el estado básico da las dos energías de ionización.
Al igual que en el benceno, en sustancias como el betacaroteno, la clorofila o el hemo, algunos electrones de los orbitales π se reparten en orbitales moleculares a lo largo de grandes distancias en una molécula, lo que da lugar a la absorción de luz en energías más bajas (el espectro visible), que explica los colores característicos de estas sustancias.[5] Este y otros datos espectroscópicos de moléculas se explican bien en la teoría MO, con énfasis en los estados electrónicos asociados con orbitales multicéntricos, incluyendo la mezcla de orbitales basada en principios de coincidencia de simetría orbital.[6] Los mismos principios MO también explican de forma natural algunos fenómenos eléctricos, como la alta conductividad eléctrica en la dirección plana de las láminas atómicas hexagonales que existen en el grafito. Esto resulta de la superposición continua de bandas de orbitales p semillenos y explica la conducción eléctrica. La teoría MO reconoce que algunos electrones en las láminas atómicas de grafito están completamente deslocalizados sobre distancias arbitrarias, y residen en orbitales moleculares muy grandes que cubren toda una lámina de grafito, y algunos electrones son así tan libres de moverse y por tanto de conducir electricidad en el plano de la lámina, como si residieran en un metal.
Historia
[editar]La teoría de orbitales moleculares fue desarrollada en los años posteriores a que se hubiese establecido la teoría del enlace de valencia (1927), principalmente a través de los esfuerzos de Friedrich Hund, Robert Mulliken, John C. Slater y John Lennard-Jones.[7] Esta teoría se llamó originalmente teoría Hund-Mulliken.[8] La palabra «orbital» fue introducida por Mulliken en 1932.[8] En 1933, la teoría de orbitales moleculares había sido aceptada como una teoría válida y útil.[9]
De acuerdo con el físico y químico alemán Erich Hückel, la primera utilización cuantitativa de la teoría orbital molecular fue en un artículo de 1929 de Lennard-Jones.[10] El primer cálculo preciso de una función de onda orbital molecular fue realizado por Charles Coulson en 1938 en la molécula de hidrógeno.[11] En 1950, los orbitales moleculares estaban completamente definidos como autofunciones (funciones de onda) del campo autoconsistente hamiltoniano y fue en este punto cuando la teoría de orbitales moleculares se convirtió en una teoría totalmente rigurosa y coherente.[12]
Este enfoque riguroso se conoce como método de Hartree-Fock para moléculas, aunque tuvo sus orígenes en los cálculos sobre átomos. De los cálculos sobre moléculas, los orbitales moleculares se expandieron en términos de un conjunto base del orbital atómico, lo que llevó a las ecuaciones de Roothaan.[13] Esto llevó al desarrollo de muchos métodos de química cuántica ab initio. En paralelo, la teoría de orbitales moleculares se aplicó de una manera más aproximada usando algunos parámetros derivados empíricamente en métodos conocidos en la actualidad como métodos de química cuántica semiempíricos.[13]
El éxito de la teoría de orbitales moleculares también generó la teoría del campo de los ligantes, que se desarrolló durante las décadas de 1930 y 1940 como una alternativa a la teoría del campo de cristal.
Método de combinación lineal de orbitales atómicos (LCAO)
[editar]En el método LCAO, cada molécula tiene un conjunto de orbitales moleculares. Se supone que el orbital molecular función de onda ψj puede escribirse como una simple suma ponderada de los n orbitales atómicoss constituyentes χi, de acuerdo con la siguiente ecuación:[14]
Se pueden determinar los coeficientes cij numéricamente sustituyendo esta ecuación en la ecuación de Schrödinger y aplicando el principio variacional. El principio variacional es una técnica matemática utilizada en mecánica cuántica para construir los coeficientes de cada base orbital atómica. Un coeficiente mayor significa que la base orbital está compuesta en mayor medida por ese orbital atómico contribuyente en particular, por lo que el orbital molecular está mejor caracterizado por ese tipo. Este método de cuantificar la contribución orbital como una combinación lineal de orbitales atómicos se utiliza en química computacional. Se puede aplicar una transformación unitaria adicional sobre el sistema para acelerar la convergencia en algunos esquemas computacionales. La teoría de orbitales moleculares se vio como competidora de la teoría del enlace de valencia en la década de 1930, antes de que se comprendiera que ambos métodos están estrechamente relacionados y que cuando se extienden se vuelven equivalentes.
Hay tres requisitos principales para que las combinaciones de orbitales atómicos sean adecuadas como orbitales moleculares aproximados.
- La combinación de orbitales atómicos debe tener la simetría correcta, lo que significa que debe pertenecer a la representación irreducible correcta del simetría molecular. Usando combinaciones lineales adaptadas a la simetría, o SALCs, se pueden formar orbitales moleculares de la simetría correcta.
- Los orbitales atómicos también deben solaparse en el espacio. No pueden combinarse para formar orbitales moleculares si están demasiado lejos unos de otros.
- Los orbitales atómicos deben estar en niveles de energía similares para combinarse como orbitales moleculares.
Tipos de orbitales
[editar]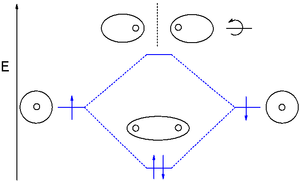
La teoría de orbitales moleculares (MO) utiliza una combinación lineal de orbitales atómicos (LCAO) para representar los orbitales moleculares resultantes de los enlaces entre átomos. A menudo se dividen en tres tipos, de enlace, de antienlace y de no enlace. Un orbital de enlace concentra la densidad electrónica en la región entre un determinado par de átomos, de modo que su densidad electrónica tenderá a atraer cada uno de los dos núcleos hacia el otro y mantener unidos a los dos átomos.[6] Un orbital antienlazante concentra la densidad de electrones "detrás" de cada núcleo (es decir, en el lado de cada átomo que está más lejos del otro átomo), por lo que tiende a alejar cada uno de los dos núcleos del otro y, de hecho, debilita el enlace entre los dos núcleos. Los electrones en orbitales no enlazantes tienden a estar asociados con orbitales atómicos que no interactúan positiva o negativamente entre sí, y los electrones en estos orbitales ni contribuyen ni restan fuerza al enlace.[6]
Los orbitales moleculares se dividen a su vez según los tipos de orbitales atómicoss a partir de los que se forman. Las sustancias químicas formarán interacciones de enlace si sus orbitales se vuelven más bajos en energía cuando interactúan entre sí. Se distinguen distintos orbitales de enlace que se diferencian por la configuración electrónica (forma de la nube de electrones) y por el nivel de energía.
Los orbitales moleculares de una molécula pueden ilustrarse en diagramas de orbitales moleculares.
Los orbitales de enlace más comunes son los sigma (σ) que son simétricos respecto al eje de enlace, y los pi (Π) con un nodal a lo largo del eje de enlace. Menos comunes son los orbitales delta (δ) y phi (φ) con dos y tres planos nodales respectivamente a lo largo del eje del enlace. Los orbitales antienlazantes se indican con un asterisco. Por ejemplo, un orbital pi antienlazante puede mostrarse como π*.
Véase también
[editar]- Efecto cis
- Interacción de configuraciones
- Teoría de orbitales moleculares frontera
- Teoría del campo de los ligantes (Teoría MO para complejos de metales de transición)
Referencias
[editar]- ↑ a b Daintith, J. (2004). Oxford Dictionary of Chemistry. Nueva York: Oxford University Press. ISBN 0-19-860918-3.
- ↑ Biasoli, Weitz, Chandías (1982). Química Orgánica. Buenos Aires: Kapelusz.
- ↑ Introduction to Molecular Orbital Theory - Imperial College London
- ↑ Mulliken, R. S. (October 1955). «Análisis de poblaciones electrónicas en funciones de onda moleculares LCAO-MO. I». The Journal of Chemical Physics 23 (10): 1833-1840. Bibcode:1955JChPh..23.1833M. ISSN 0021-9606. doi:10.1063/1.1740588.
- ↑ Griffith, J.S. y L.E. Orgel. "Ligand Field Theory". Q. Rev. Chem. Soc. 1957, 11, 381-383
- ↑ a b c Miessler y Tarr (2013), Química Inorgánica, 5ª ed, 117-165, 475-534.
- ↑ Coulson, Charles, A. (1952). Valence. Oxford at the Clarendon Press.
- ↑ a b «Spectroscopy, Molecular Orbitals, and Chemical Bonding» (pdf). Nobel Lectures, Chemistry 1963–1970. Amsterdam: Elsevier Publishing Company. 1972 [1966].
- ↑ Hall, George G. Lennard-Jones Paper of 1929 «Foundations of Molecular Orbital Theory.». Advances in Quantum Chemistry 22. Bibcode:1991AdQC...22....1H. ISBN 978-0-12-034822-0. ISSN 0065-3276. doi:10.1016/S0065-3276(08)60361-5.
- ↑ Hückel, Erich (1934). «Theory of free radicals of organic chemistry». Trans. Faraday Soc. 30: 40-52. doi:10.1039/TF9343000040.
- ↑ Coulson, C.A. (1938), «Self-consistent field for molecular hydrogen», Mathematical Proceedings of the Cambridge Philosophical Society 34 (2): 204-212, Bibcode:1938PCPS...34..204C, doi:10.1017/S0305004100020089.
- ↑ Hall, G.G. (7 de agosto de 1950). «The Molecular Orbital Theory of Chemical Valency. VI. Properties of Equivalent Orbitals» (pdf). Proc. Roy. Soc. A 202 (1070): 336-344. Bibcode:1950RSPSA.202..336H. doi:10.1098/rspa.1950.0104.
- ↑ a b Jensen, Frank (1999). Introduction to Computational Chemistry. John Wiley and Sons. ISBN 978-0-471-98425-2.
- ↑ Licker, Mark, J. (2004). McGraw-Hill Enciclopedia Concisa de Química. Nueva York: McGraw-Hill. ISBN 978-0-07-143953-4.
Enlaces externos
[editar]- Molecular Orbital Theory - Purdue University
- Molecular Orbital Theory - Sparknotes
- Molecular Orbital Theory Archivado el 27 de noviembre de 2020 en Wayback Machine. - Mark Bishop's Chemistry Site
- Introduction to MO Theory - Queen Mary, London University
- Molecular Orbital Theory Archivado el 28 de mayo de 2009 en Wayback Machine. - a related terms table
- An introduction to Molecular Group Theory - Oxford University


