Síntesis de indoles de Nenitzescu
La síntesis de indoles de Nenitzescu es un método de preparación de derivados de 5-hidroxiindol a partir de benzoquinona y ésteres β-aminocrotónicos.
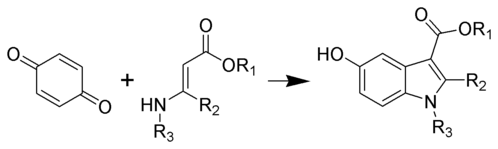
Esta reacción fue nombrada por su descubridor, Costin Nenițescu, quien la informó por primera vez en 1929. Se puede realizar con varias combinaciones diferentes de grupos R, que incluyen sustituyentes metilo, metoxi, etilo, propilo y H. También hay una variación de estado sólido en la que la reacción tiene lugar en un armazón de polímero altamente reticulado. La síntesis es particularmente interesante porque los índoles son la base de una serie de moléculas bioquímicamente importantes, incluidos los neurotransmisores y compuestos antitumorales..[1][2][3][4]
Mecanismo[editar]
El mecanismo de la reacción de Nenitzescu consiste en una adición de Michael, seguida de un ataque nucleofílico por el enlace π de la enamina, y luego una eliminación.[5]
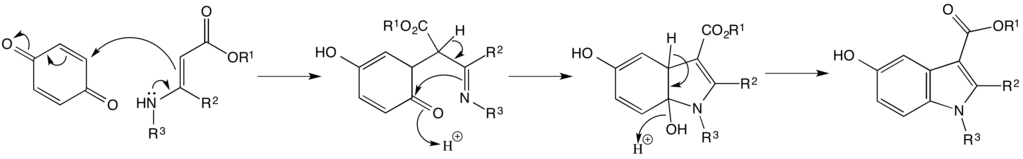
La reacción fue publicada por primera vez por Nenitzescu en 1929, y desde entonces Allen et al[2].[1] En su publicación de 1966, Allen y sus colegas investigaron los efectos que los diferentes sustituyentes en el material de partida de benzoquinona tuvieron en la disposición del producto final. Estos efectos estéricos también evidenciaron que uno de los dos mecanismos actuales propuestos era más probable que el otro, lo que condujo a la publicación del mecanismo que se muestra arriba.
Condiciones[editar]
Un estudio preliminar realizado por Katkevica et al. investigó las condiciones de reacción para una síntesis de Nenitzescu e informó sobre el comportamiento de la reacción cuando tiene lugar en varios solventes. Sus resultados indicaron que la reacción funciona mejor en un solvente altamente polar, y se propusieron estudios cinéticos adicionales que implican la variación del sustrato, reactivos, solventes y la presencia de ácidos y bases de Lewis. Dos años después, Velezheva et al. continuó informando una versión alternativa de la síntesis usando un catalizador ácido de Lewis. Informan que el efecto catalizador se origina en la activación de la enamina a través de un complejo de dicetodienamina-ZnCl2.[6][7]
Sin embargo, a pesar de las mejoras en las condiciones, la síntesis tradicional de Nenitzescu no era adecuada para su uso en una escala de fabricación debido a un rendimiento y polimerización relativamente bajos en condiciones de reacción normales. Originalmente, se creía que la benzoquinona tenía que usarse en un exceso del 100% para impulsar la reacción hasta su finalización en esta escala, pero Huang et al. informó que un exceso de 20 a 60% es más efectivo. Además, informaron que para las condiciones ideales para una reacción a gran escala, debería haber una relación molar 1: 1.2-1.6 entre la benzoquinona y el 3-aminocrotonato de etilo, y la reacción debería tener lugar alrededor de la temperatura ambiente. Estas condiciones son suficientes para producir lotes de 100 kg o más..[8]
Variaciones y reacciones relacionadas[editar]
Una de las variaciones más comunes de la reacción de Nenitzescu es la variante de Ketcha et al con catálisis en fase sólida.[3]
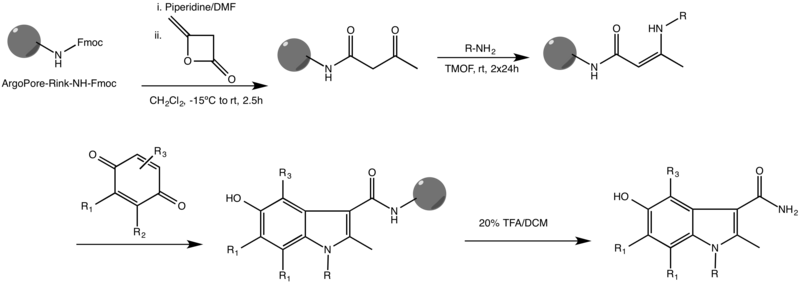
La reacción se lleva a cabo en una resina ArgoPore®-Rink-NH-Fmoc altamente reticulada y funciona con una variedad de sustituyentes en ambos reactivos. También se informaron otras síntesis de indol en fase sólida, algunas de las cuales utilizan diferentes andamios y catalizadores metálicos para impulsar la reacción hasta su finalización.
También hay una variedad de otras reacciones que resultan en el mismo esqueleto de indol. En un artículo de revisión, Taber et al. clasifica estas reacciones en nueve tipos básicos de síntesis de indol: Fischer, Mori, Hemetsberger, Buchwald, Sundberg, Madelung, Nenitsescu, van Leusen y Kanematsu.[9]
Aplicaciones[editar]
El esqueleto de 5-hidroxiindol es la base de varias moléculas bioquímicamente importantes. Entre ellos están la serotonina, un neurotransmisor; indometacina, un agente antiinflamatorio no esteroideo; L-761,066, un inhibidor de COX-2; y LY311727, un inhibidor de la fosfolipasa secretora. Actualmente, una de las aplicaciones más interesantes de la síntesis de Nenitzescu es su capacidad para producir un precursor de compuestos antitumorales. Esta síntesis, reportada en 2006, involucra la reacción de 1,4,9,10-antradiquinona con varias enaminas. Los productos de esta reacción constituyen una nueva clase de estructuras de plomo para el diseño de fármacos contra el cáncer..[3][4]
Referencias[editar]
- ↑ a b Nenitzescu, C.D. (1929). «Derivatives of 2-methyl-5-hydroxyindole». Bull. Soc. Chim. Romania 11: 37-43.
- ↑ a b Allen, G.; Pidacks, C.; Weiss, M. (5 de junio de 1996). «The Mitomycin Antibiotics. Synthetic Studies». J. Am. Chem. Soc. 88 (11): 2536-2544. PMID 5941382. doi:10.1021/ja00963a032.
- ↑ a b c Ketcha, Daniel M.; Wilson, L.J.; Portlock, D.E. (2000). «The solid-phase Nenitzescu indole synthesis». Tetrahedron Letters 41 (33): 6253-6257. doi:10.1016/S0040-4039(00)00697-3.
- ↑ a b Schenck, Lothar Werner; Kuna, K.; Frank, W.; Albert, A.; Asche, C.; Kucklaender, U. (10 de enero de 2006). «1,4,9,10-Anthradiquinone as precursor for antitumor compounds». Bioorganic & Medicinal Chemistry 14 (10): 3599-3614. PMID 16458517. doi:10.1016/j.bmc.2006.01.026.
- ↑ Li, Jie Jack (2009). Name Reactions, 4th ed.. Berlin: Springer-Verlag. pp. 391–392. ISBN 3642010520.
- ↑ Katkevica, Daze; Trapencieris, P.; Boman, A.; Kalvins, I.; Lundstedt, T. (2004). «The Nenitzescu reaction: an initial screening of experimental conditions for improvement of the yield of a model reaction». J. Chemometrics 18: 1883-187. doi:10.1002/cem.863.
- ↑ Velezheva, Valeriya S.; Sokolov, A.I.; Kornienko, A.G.; Lyssenko, K.A.; Nelyubina, Y.V.; Godovikov, I.A.; Peregudov, A.S.; Mironov, A.F. (15 de septiembre de 2008). «The orle of a Lewis acid in the Nenitzescu indole synthesis». Tetrahedron Letters 49 (50): 7106-7109. doi:10.1016/j.tetlet.2008.09.087.
- ↑ Huang, Yun-Sheng; Zhang, W.; Zhang, X.; Wang, J. (2010). «Manufacturing synthesis of 5-hydroxy-2-methyl-1H-indole». Research on Chemical Intermediates 36 (8): 975-983. doi:10.1007/s11164-010-0210-x.
- ↑ Taber, Douglass F.; Tirunahari, P.K. (21 de junio de 2011). «Indole synthesis: a review and proposed classification». Tetrahedron 67 (38): 7195-7210. PMC 4255418. doi:10.1016/j.tet.2011.06.040.
