Síntesis de derivados de 3,3-bis(indolil)metanos
La síntesis de derivados de 3,3-bis(indolil)metanos, α-indol-3-il α-hidroximetanos, α-indol-3-il cetonas y α,α- bis(indol-3-il)cetonas poseen en su estructura uno o dos indoles. Estos heterociclos aromáticos son probablemente uno de los más ubicuos de la naturaleza.[1] Debido a la gran variedad estructural de los indoles y su potencial actividad biológica, no es sorprendente que estos sistemas se hayan convertido en un importante componente estructural de algunos fármacos.[2] Además, los indoles han demostrado que son capaces de unirse a una amplia variedad de moléculas con una elevada afinidad.[3] Durante más de 100 años, la síntesis y funcionalización de estos compuestos aromáticos ha sido un área de gran interés para numerosos grupos de investigación dedicados a la síntesis orgánica, por lo que se han desarrollado numerosos métodos para la preparación de indoles.[4] Sin embargo, el objetivo de este trabajo de revisión bibliográfica no es analizar los distintos métodos que existen para la preparación de indoles, sino su utilización para preparar moléculas con un mayor grado de funcionalización.
Métodos de preparación
[editar]En los últimos años se han encontrado compuestos naturales en cuyas estructuras están presentes bis(1H-indol-3-il)metanos.[5] Además, se ha comprobado que pueden exhibir una importante actividad biológica, por lo que la síntesis de este tipo de compuestos se han convertido en uno de los retos de la química orgánica.[6] Se han diseñado diferentes metodologías para la síntesis de este tipo de compuestos, empleando como reactivo electrofílico un aldehído.[7]
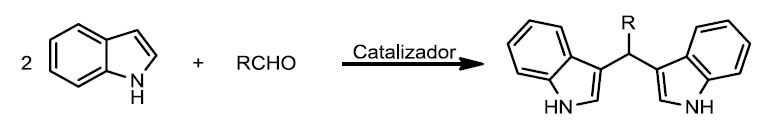
La reacción de indoles con aldehídos y cetonas utilizando triflatos de distintos lantánidos ha demostrado ser una reacción muy eficiente para la síntesis de bisindoles, ya que proporciona rendimientos que van desde el 47 al 99%. De entre todos los lantánidos que se han empleado, el disprosio ha resultado ser el más efectivo. En el siguiente esquema se muestran las condiciones de reacción, donde se observa que el catalizador utilizado es el triflato de disprosio (III) y que se utiliza una mezcla etanol:agua 3:1.[8]
Otro catalizador que ha demostrado ser altamente efectivo en la catálisis de la reacción entre indoles y benzaldehídos es el tricloruro de indio. La reacción se lleva a cabo a temperatura ambiente, utilizando acetonitrilo como disolvente.[9]
Otra ruta interesante para la formación de bisindoles, es la utilización de sustratos carbonílicos más funcionalizados. Uno de los primeros sustratos que se utilizó fue el ácido oxoacético, empleando ácido sulfúrico como disolvente y catalizador. La principal ventaja de este método es que la cinética de la reacción es muy rápida, llegando a acabar en 30 minutos con un rendimiento superior al 95%.[10]
Más recientemente, Marcantoni y colaboradores han desarrollado un método altamente eficiente para la síntesis de diferentes bisindolil metanos empleando como catalizador tricloruro de cerio heptahidrato, junto con yoduro de sodio y SiO2. Una de las principales ventajas es que la reacción se lleva a cabo en ausencia de disolvente, reduciendo los costes. Además, el rendimiento obtenido para la mayoría de los productos finales es superior al 80%.[11]
Otro ejemplo que permite obtener bisindolil metanos es el propuesto por Chakrabarty y colaboradores. Considerando los costes medioambientales y económicos que suponen la utilización de disolventes orgánicos y catalizadores metálicos, estos investigadores han empleado ácido ortofosfórico (10 mol%) en SiO2 combinando un primer periodo a 60-70 °C y un segundo a temperatura ambiente. Empleando estas condiciones, la reacción no sólo finaliza en menos de una hora, sino que el rendimiento de la misma es superior al 90%. Otra de las ventajas que proporciona esta metodología es que la posibilidad de emplear indoles funcionalizados en la posición 6.[12]
En 2017, un grupo de investigación de la Universidad de Burgos desarrolló un procedimiento que permite la obtención de bisindolilcetonas a partir, no solo de glioxales aromáticos como hemos visto en los ejemplos anteriores, sino glioxales alquílicos. El principal inconveniente de emplear estos reactivos, es que están presentes en disoluciones acuosas para mantener su estabilidad, lo que complica en gran medida su miscibilidad con disolventes orgánicos como el benceno y el tolueno (disolventes más comunes para sintetizar BIMs).[13]
Otros compuestos de interés
[editar]Otros compuestos de estructura similar a los protagonista de este artículo son: α-Indol-3-il cetonas y las α,α-Bis(Indol-3-il)cetonas. Estos pueden emplearse en la síntesis de carbazoles, compuestos de elevado interés comercial.[14]
Referencias
[editar]- ↑ G. R. Humphrey, J. T. Kuethe, Chem. Rev. 2006, 106, 2875–2911.
- ↑ R. J. Sundberg, The chemistry of indoles, Academic Press: New York, 1970.
- ↑ D. A. Horton, G. T. Bourne, M. L. Smythe, Chem. Rev. 2003, 103, 893–930.
- ↑ a) G. W. Gribble, J. Chem. Soc. Perkin Trans, 2000, 1, 1045–1075. b) T. L. Gilchrist, J. Chem. Soc. Perkin Trans, 2001, 1, 2491–2515.
- ↑ T. S. Kam, In Alkaloids, Chemical and Biological Perspectives, Vol. 4; Pelletier, S. W., Ed.; Pergamon: Amsterdam, 1999, 285.
- ↑ a) S. A. Morris, R. J. Anderson, Tetrahedron 1990, 46, 715–720. b) K. Umezawa, T. Ohse, T. Yamamoto, Y. Koyano, Takahashi, Anticancer Res. 1994, 14, 2413–2417. c) G. Bifulco, I. Bruno, R. Riccio, J. Lavayre, G. Bourdy, J. Nat. Prod. 1995, 58, 1254–1260. d) N. Amino, T. Ohse, T. Koyano, K. Umezawa, Anticancer Res. 1996, 16, 55–59. e) K. Umezawa, T. Taniguchi, M. Toi, T. Ohse, T. Isutsumi, T. Yamamoto, T. Koyano, M. Ishizuka, Drugs Exp. Clin. Res. 1996, 22, 35–40.
- ↑ M. Shiri, M. A. Zolfigol, H. G. Kruger, Z. Tanbakouchian, Chem. Rev. 2010, 110, 2250–2293.
- ↑ A. Kamal, A. A. Qureshi, Tetrahedron 1963, 19, 512–520.
- ↑ H. Singh, R. Sarin, K. Singh, Heterocycles 1986, 24, 3039–3042.
- ↑ M. Julia, G. Tilly, Bull. Chem. Soc. Fr. 1965, 2175–2182.
- ↑ E. Marcantoni, Synthesis 2004, 6, 895–900.
- ↑ M. Chakrabarty, R. Mukherjee, A. Mukherji, S. Arima, Y. Harigaya, Heterocycles 2006, 68, 1659–1668.
- ↑ A. Suárez, F. Martínez, S. Suárez-Pantiga, R. Sanz, ChemistrySelect, 2017, 2, 787–790.
- ↑ M. Bashir, A. Bano, A. S. Ijaz, B. A. Chaudhary, Molecules, 2015, 20, 13496–13517.
