Reacción de Horner–Wadsworth–Emmons
La reacción de Horner-Wadsworth-Emmons (HWE) (también conocida como la reacción de Wittig-Horner) es una reacción química utilizada en química orgánica de un carbanión fosfonato estabilizado con un aldehído o cetona para producir, predominantemente, un E - alqueno.[1]
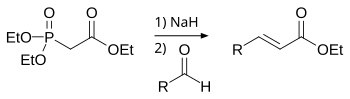
En 1958, Leopold Horner publicó una reacción de Wittig modificada usando carbaniones estabilizados con fosfonato.[2][3] William S. Wadsworth y William D. Emmons definieron aún más la reacción[4][5]
En contraste con el iluro de fosfonio utilizado en la reacción de Wittig, los carbaniones estabilizados con fosfonato son más nucleofílicos pero menos básicos. Del mismo modo, carbaniones estabilizados con fosfonato pueden ser alquilados. A diferencia de los iluros de fosfonio, el subproducto de la reacción es la sal de dialquilfosfato que se elimina fácilmente por extracción líquido-líquido acuosa.
Varias revisiones han sido publicadas.[6][7][8][9][10][11]
Mecanismo de reacción[editar]
La reacción de Horner-Wadsworth-Emmons comienza con la desprotonación del fosfonato para dar el carbanion fosfonato 1. La adición nucléofila del carbanión en el aldehído (o cetona) 2 que produce 3a o 3b es el paso limitante de la velocidad.[12] Si R2 = H, los intermedirios 3a y 4a y los intermediarios 3b y 4b pueden interconvertirse uno con el otro.[13] La eliminación final de 4a y 4b produce el (E) - alqueno 5 y el (Z ) - alqueno 6.

La relación de los alquenos 5 y 6 depende del resultado estereoquímico de la adición del carbanión inicial y de la capacidad de los compuestos intermedios para alcanzar el equilibrio químico.
El grupo atractor de electrones (EWG) alfa al fosfonato es necesario para que ocurra la eliminación final. En ausencia de un grupo atractor de electrones, el producto final es el α-hidroxifosfonato 3a y 3b.[14] Sin embargo, estos α-hidroxifosfonatos se pueden transformar en alquenos por reacción con diisopropilcarbodiimida.[15]
Estereoselectividad[editar]
La reacción de Horner-Wadsworth-Emmons favorece la formación del (E) - alquenos. En general, cuanto más equilibrado entre los intermedios, mayor es la selectividad para la formación del (E) - alqueno.
Alquenos sustituidos[editar]
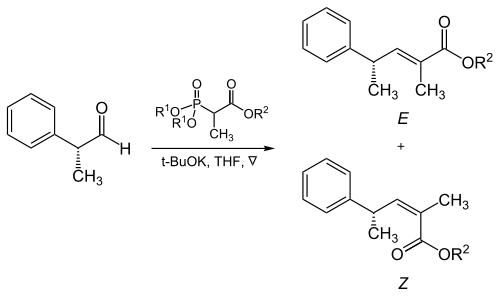
Thompson y Heathcock han realizado un estudio sistemático de la reacción del 2-(dimetoxifosforilo)acetato de metilo con varios aldehídos.[16] Si bien cada efecto era pequeño, tenían un efecto acumulativo que permitía modificar el resultado estereoquímico sin modificar la estructura del fosfonato. Encontraron mayor estereoselectividad (E) con las siguientes condiciones:
- Aumento del volumen estérico del aldehído
- Temperaturas de reacción más altas (23 °C mejor que -78 °C)
- Sales de Li > Na > K
- Usando el disolvente DME en lugar de THF
Otro estudio mostró que los fosfonatos impedidos estéricamente y los grupos electroaltractores, también aumentan la selectividad de (E)-alquenos.
Alquenos trisustituidos[editar]
El volumen estérico de los fosfonato y los grupos electroatractores juegan un papel crítico en la reacción de los fosfonatos ramificados con aldehídos alifáticos:[17]
| R1 | R2 | Ratio de alquenos ( E : Z ) |
|---|---|---|
| Metilo | Metilo | 5 : 95 |
| Metilo | Etilo | 10 : 90 |
| Etilo | Etilo | 40 : 60 |
| Isopropilo | Etilo | 90 : 10 |
| Isopropilo | Isopropilo | 95 : 5 |
Los aldehídos aromáticos producen casi exclusivamente (E)-alquenos. En caso de que se necesiten (Z)-alquenos de aldehídos aromáticos, se puede utilizar la modificación Still-Gennari (ver más abajo).
Olefinación de cetonas[editar]
La estereoselectividad de la reacción de las cetonas de Horner-Wadsworth-Emmons es de pobre a moderada.
Variantes[editar]
Sustratos sensibles a bases[editar]
Dado que muchos sustratos no son estables al hidruro de sodio, se han desarrollado varios procedimientos utilizando bases más suaves. Masamune y Roush han desarrollado condiciones leves con cloruro de litio y DBU.[18] Rathke extendió esto a haluros de litio o magnesio con trietilamina.[19] Se han encontrado varias otras bases efectivas.[20][21][22]
Modificación de Still[editar]
W. Clark Still y C. Gennari han desarrollado condiciones que dan (Z)-alquenos con excelente estereoselectividad.[23] El uso de fosfonatos con grupos electroatractores (trifluoroetilo[24]) junto con condiciones fuertemente disociantes (KHMDS y 18-corona-6 en THF) puede lograr una producción de (Z)-alquenos casi en exclusiva.
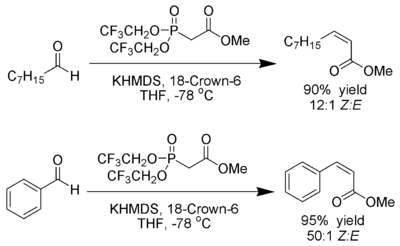
Ando ha sugerido que el uso de fosfonatos deficientes en electrones aceleran la eliminación de los intermedios oxafosfetano.[25]
Véase también[editar]
- Reacción de Wittig
- Reacción de Michaelis-Arbuzov
- Reacción de Michaelis-Becker
- Reacción de Peterson
- Olefinación de Tebbe
Referencias[editar]
- ↑ Wadsworth, W. Org. React. 1977, 25, 73. doi 10.1002/0471264180.or025.02
- ↑ Leopold Horner; Hoffmann, H. M. R.; Wippel, H. G. Ber. 1958, 91, 61–63.
- ↑ Horner, L.; Hoffmann, H. M. R.; Wippel, H. G.; Klahre, G. Ber. 1959, 92, 2499–2505.
- ↑ Wadsworth, W. S., Jr.; Emmons, W. D. J. Am. Chem. Soc. 1961, 83, 1733. (doi 10.1021/ja01468a042)
- ↑ Wadsworth, W. S., Jr.; Emmons, W. D. Organic Syntheses, Coll. Vol. 5, p.547 (1973); Vol. 45, p.44 (1965). (Article)
- ↑ Wadsworth, W. S., Jr. Org. React. 1977, 25, 73–253. (Review)
- ↑ Boutagy, J.; Thomas, R. Chem. Rev. 1974, 74, 87–99. (Review, doi 10.1021/cr60287a005)
- ↑ Kelly, S. E. Comp. Org. Syn. 1991, 1, 729–817. (Review)
- ↑ B. E. Maryanoff; Reitz, A. B. Chem. Rev. 1989, 89, 863–927. (Review, doi 10.1021/cr00094a007)
- ↑ Bisceglia, J. A., Orelli, L. R. Curr. Org. Chem. 2012, 16, 2206–2230 (Review)
- ↑ Bisceglia, J. A., Orelli, L. R. Curr. Org. Chem. 2015, 19, 744–775 (Review)
- ↑ Larsen, R. O.; Aksnes, G. Phosphorus Sulfur 1983, 15, 218–219.
- ↑ Lefèbvre, G.; Seyden-Penne, J. J. Chem Soc., Chem. Commun. 1970, 1308–09.
- ↑ Corey, E. J.; Kwiatkowski, G. T. J. Am. Chem. Soc. 1966, 88, 5654–56. (doi 10.1021/ja00975a057)
- ↑ Reichwein, J. F.; Pagenkopf, B. L. J. Am. Chem. Soc. 2003, 125, 1821–24. (doi 10.1021/ja027658s)
- ↑ Thompson, S. K.; Heathcock, C. H. J. Org. Chem. 1990, 55, 3386–88. (doi 10.1021/jo00297a076)
- ↑ Nagaoka, H.; Kishi, Y. Tetrahedron 1981, 37, 3873–3888.
- ↑ Blanchette, M. A.; Choy, W.; Davis, J. T.; Essenfeld, A. P.; Masamune, S.; Roush, W. R.; Sakai, T. Tetrahedron Letters 1984, 25, 2183–2186.
- ↑ Rathke, M. W.; Nowak, M. J. Org. Chem. 1985, 50, 2624–2626. (doi 10.1021/jo00215a004)
- ↑ Paterson, I.; Yeung, K.-S.; Smaill, J. B. Synlett 1993, 774.
- ↑ Simoni, D.; Rossi, M.; Rondanin, R.; Mazzali, A.; Baruchello, R.; Malagutti, C.; Roberti, M.; Invidiata, F. P. Org. Letters 2000, 2, 3765–3768.
- ↑ Blasdel, L. K.; Myers, A. G. Org. Letters 2005, 7, 4281–4283.
- ↑ Still, W. C.; Gennari, C. Tetrahedron Letters 1983, 24, 4405–4408.
- ↑ Patois, C.; Savignac, P.; About-Jaudet, E.; Collignon, N. Organic Syntheses, Coll. Vol. 9, p.88 (1998); Vol. 73, p.152 (1996). (Article Archivado el 30 de septiembre de 2007 en Wayback Machine.)
- ↑ Ando, K. J. Org. Chem. 1997, 62, 1934–1939. (doi 10.1021/jo970057c)
