Punto isosbéstico
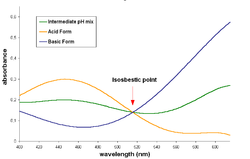
En espectroscopia, un punto isosbéstico es una longitud de onda concreta, número de onda o frecuencia en la que la absorbancia total de una muestra no cambia durante una reacción química o un cambio físico de la muestra. La palabra deriva de dos palabras griegas: "iso", significando "igual", y "sbestos", significando "extinguible".[1]
Trazado isosbéstico[editar]
Cuando un trazado isosbéstico está construido por superposición de la absorción espectral de dos substancias (ya sea por utilizando la Absortividad molar para la representación, o utilizando la absorbancia (pero manteniendo la misma concentración molar para ambas substancias), el punto isosbéstico corresponde a una longitud de onda en la que estos espectros se cruzan entre sí .
Un par de sustancias pueden tener varios puntos isosbésticos en su espectro.
Cuando una reacción química 1-a-1, incluyendo el estado de equilibrio (un mol de reactante da un mol de producto) implica un par de sustancias con un punto isosbéstico, la absorbancia de la mezcla de la reacción permanece invariable en esa longitud de onda, sin tener en cuenta la extensión de la reacción (o la posición de equilibrio químico). Esto ocurre porque las dos sustancias absorben luz de una longitud de onda determinada en la misma relación, y la concentración analítica permanece constante
Para la reacción:
La concentración analítica es igual en cualquier punto de la reacción:
- .
La absorbancia de la mezcla en reacción (suponiendo que depende sólo de X e Y) es:
- .
Pero en el punto isosbéstico, ambos factores de absorción molares son iguales:
- .
De ahí, que la absorbancia
No depende de la extensión de la reacción (i.e., en las concentraciones particulares de X y Y)
El requisito para que un punto isosbéstico tenga lugar, es que las dos substancias implicadas estén relacionadas linealmente por la estequiometría, tal que la absorbancia sea invariante para una longitud de onda determinada. Por ello son posibles otras proporciones distintas de la relación uno a uno . La presencia de un punto isosbéstico indica típicamente que sólo dos substancias que varíen en concentración pueden contribuir a la absorción alrededor del punto isosbéstico.
Si una tercera substancia toma parte en el proceso el espectro cruza típicamente en longitudes de onda variables cuando cambian las concentraciones, creando la impresión que el punto isosbéstico está 'fuera de foco', o que cambiará cuando cambien las condiciones.[2] La razón para este caso, es que es muy improbable que, por casualidad, tres compuestos tengan coeficientes de extinción enlazados en una relación lineal para una longitud de onda determinada.
Aplicaciones[editar]

En cinética química, punto isosbéstico se utiliza como punto de referencia en el estudio de la velocidad de reacción, cuando la absorbancia en aquellas longitudes de onda permanece constante durante la reacción entera.
Los puntos isosbésticos se utilizan en medicina en una técnica de laboratorio llamada pulsioximetría para determinar la concentración de hemoglobina, sin tener en cuenta su saturación. La Oxihemoglobina y la des-Oxihemoglobina tienen (no exclusivamente) puntos isosbésticos en 586 nm y cerca de 808 nm.
Los puntos isosbésticos también se utilizan en química clínica, como método de garantía de calidad, para verificar la exactitud de un espectrofotómetro en la medida de longitud de onda. Se usa para poder medir el espectro de una sustancia estándar en dos condiciones de pH diferentes (por encima y por debajo el pKa de la sustancia). Los estándares utilizados incluyen el Dicromato de potasio (puntos isosbésticos en 339nm y 445 nm), el azul de bromothymol (325 y 498 nm), el Rojo Congo (541 nm) y el Verde de bromocresol. La longitud de onda de un punto isosbéstico determinado no depende de la concentración de la sustancia utilizada, y por lo tanto se convierte en una referencia muy fiable .
Véase también[editar]
Referencias[editar]
- ↑ IUPAC Gold Book (International Union of Pure and Applied Chemistry)
- ↑ page 49 of Kinetics and Mechanism By John W. Moore, Ralph G. Pearson and Arthur Atwater Frost (3rd Edition, John Wiley and Sons, 1981) ISBN 0-471-03558-0, ISBN 978-0-471-03558-9





