Ortosilicato
En química y mineralogía, el ortosilicato es el anión SiO4−
4, o cualquiera de sus sales y ésteres. Es uno de los aniones de silicato. Ocasionalmente se llama anión o grupo de tetróxido de silicio.[1]
Las sales de ortosilicato, como el ortosilicato de sodio, son estables y se encuentran ampliamente en la naturaleza como minerales de silicato, siendo la característica definitoria de los nesosilicatos.[2] La olivina, un ortosilicato de magnesio o hierro (II), es el mineral más abundante en el manto superior.
El anión ortosilicato es una base fuerte, la base conjugada del ácido ortosilícico extremadamente débil H
4SiO
4 (pKa2 = 13.2 a 25 °C). Este equilibrio es difícil de estudiar ya que el ácido tiende a descomponerse en un condensado de sílice hidratado.[3]
Estructura
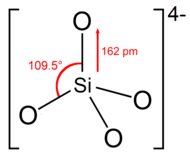
[editar]El ion o grupo de ortosilicato tiene forma tetraédrica, con un átomo de silicio rodeado por cuatro átomos de oxígeno.
En el anión, cada oxígeno lleva una unidad de carga negativa.[4] El enlace Si – O es 162 pm de largo.[5]
En compuestos orgánicos como el ortosilicato de tetrametilo, cada oxígeno es formalmente neutro y está conectado al resto de la molécula por un enlace covalente único.
Usos
[editar]El ortosilicato de bario dopado con europio (Ba2SiO4) es un fósforo común utilizado en diodos emisores de luz (LED) verdes. El fósforo para LED azules se puede hacer con ortosilicato de bario dopado con estroncio.[6] El ortosilicato de bario es una causa importante de intoxicación por cátodos en tubos de vacío.[7]
Química orgánica
[editar]Aunque es muy importante en la química inorgánica y la geoquímica, los iones de ortosilicato rara vez se ven en la química orgánica. Sin embargo, se usan dos compuestos de silicato en la síntesis orgánica: el ortosilicato de tetraetilo o TEOS se usa para unir polímeros, y es especialmente importante en la fabricación de aerogeles. El ortosilicato de tetrametilo o TMOS se usa como una alternativa a TEOS, y también tiene otros usos como reactivo. Se prefiere TEOS sobre TMOS ya que TMOS se descompone para producir altas concentraciones de metanol tóxico. La inhalación de TMOS puede provocar una acumulación tóxica de sílice en los pulmones.
Referencias
[editar]- ↑ C. A. Kumins, and A. E. Gessler (1953), "Short-Cycle Syntheses of Ultramarine Blue". Indunstrial & Engineering Chemistry, volume 45, issue 3, pages 567–572. doi 10.1021/ie50519a031
- ↑ Western Oregon University
- ↑ Jurkić, Lela Munjas; Cepanec, Ivica; Pavelić, Sandra Kraljević; Pavelić, Krešimir (2013). «Biological and therapeutic effects of ortho-silicic acid and some ortho-silicic acid-releasing compounds: New perspectives for therapy». Nutrition & Metabolism 10 (1): 2. ISSN 1743-7075. PMC 3546016. doi:10.1186/1743-7075-10-2.
- ↑ Balaram Sahoo; Nayak Nimai Charan; Samantaray Asutosh; Pujapanda Prafulla Kumar. Inorganic Chemistry. PHI Learning Pvt. Ltd. p. 306. ISBN 978-81-203-4308-5.
- ↑ Horacio E. Bergna; William O. Roberts (19 de diciembre de 2005). Colloidal Silica: Fundamentals and Applications. CRC Press. p. 10. ISBN 978-1-4200-2870-6.
- ↑ Huayna Cerqueira Streit, Jennifer Kramer, Markus Suta, Claudia Wickleder, "Red, green, and blue photoluminescence of Ba₂SiO4:M (M = Eu3+, Eu2+, Sr2+) nanophosphors", Materials (Basel), vol. 6, iss. 8, pp. 3079–3093, 24 July 2013 doi 10.3390/ma6083079.
- ↑ Jones, Morgan (Electronics engineer) (2011). Valve amplifiers (4th ed edición). Newnes. p. 301. ISBN 978-0-08-096640-3. OCLC 760157359.
