Mostazas nitrogenadas

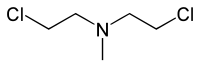

Las mostazas nitrogenadas (NMs) son compuestos orgánicos citotóxicos con el grupo funcional bis(2-cloroetil)amino ((ClC2H4)2NR).[1] Aunque originalmente se produjeron como agentes de guerra química,[2][3] fueron los primeros agentes quimioterapéuticos para el tratamiento del cáncer. [4] Las mostazas nitrogenadas son agentes alquilantes de ADN no específicos.
Nombre
[editar]Las mostazas nitrogenadas no están relacionadas con la planta de mostaza, ni con su esencia picante, cuyo principio activo es el isotiocianato de alilo; el nombre proviene del olor penetrante de las preparaciones de armas químicas.[5]
Guerra química
[editar]Durante la Segunda Guerra Mundial, Alfred Gilman y Louis Goodman estudiaron las mostazas nitrogenadas en la Escuela de Medicina de Yale y, en diciembre de 1942, comenzaron los ensayos clínicos en humanos con mostazas nitrogenadas para el tratamiento del linfoma.[6] A principios de diciembre de 1943, un incidente durante el ataque aéreo sobre Bari, Italia, provocó la liberación de gas mostaza, lo que afectó a varios cientos de soldados y civiles.[7]Cuando se realizó el examen médico a los supervivientes, se observó una disminución del número de linfocitos.[8] Una vez terminada la Segunda Guerra Mundial, el incidente de Bari junto con los estudios del grupo de Yale convergieron, lo que impulsó la búsqueda de otros compuestos similares. Debido a su uso en estudios previos, la mostaza nitrogenada conocida como “HN2” se convirtió en el primer fármaco de quimioterapia: la mustina.
Ejemplos
[editar]La mostaza nitrogenada mustina (HN2) ya no se utiliza habitualmente en su formulación intravenosa original debido a su excesiva toxicidad. Otras mostazas nitrogenadas desarrolladas incluyen ciclofosfamida, clorambucilo, uramustina, melfalán y bendamustina .[9] La bendamustina ha resurgido recientemente como un tratamiento quimioterapéutico viable.[10]
Las mostazas nitrogenadas que pueden emplearse con fines bélicos están estrictamente reguladas. Las designaciones de sus armas son:[11]
- HN1: bis(2-cloroetil)etilamina
- HN2: bis(2-cloroetil)metilamina
- HN3: tris(2-cloroetil)amina
La normustard (mustina sin un grupo metilo en el átomo de nitrógeno; bis(2-cloroetil)etilamina) se puede utilizar en la síntesis de fármacos piperazínicos, como la mazapertina, el aripiprazol y la fluanisona. La canfosfamida también se elabora a partir de mostaza común.
También se prepararon algunas mostazas nitrogenadas de opiáceos, aunque no se sabe si son antineoplásicas. Los ejemplos incluyen clornaltrexamina y cloroximorfamina.
Mecanismo de acción
[editar]Las mostazas nitrogenadas forman iones de amonio cíclicos (iones aziridinio) por desplazamiento intramolecular del cloruro por el nitrógeno de la amina. Este grupo aziridinio luego alquila el ADN una vez que es atacado por el centro nucleofílico N-7 en la base de guanina. Un segundo ataque después del desplazamiento del segundo cloro forma el segundo paso de alquilación que da como resultado la formación de enlaces cruzados entre cadenas (ICL), como se demostró a principios de la década de 1960. En ese momento, se propuso que los ICL se formaban entre el átomo N-7 del residuo de guanina en una secuencia 5'-d(GC). [12] [13] Más tarde se demostró claramente que las mostazas nitrogenadas forman un ICL 1,3 en la secuencia 5'-d(GNC).[14][15][16][17]
El fuerte efecto citotóxico causado por la formación de ICL es lo que hace que los NMs sean agentes quimioterapéuticos eficaces. Otros compuestos utilizados en la quimioterapia contra el cáncer que tienen la capacidad de formar ICL son el cisplatino, la mitomicina C, la carmustina y el psoraleno.[18] Este tipo de lesiones son efectivas para forzar a la célula a sufrir apoptosis a través de p53. Hay que tener en cuenta que el daño alquilante en sí mismo no es citotóxico y no causa directamente la muerte celular.
Seguridad
[editar]Las mostazas nitrogenadas son agentes vesicantes potentes y persistentes. Por tanto, las HN1, HN2 y HN3 se clasifican como sustancias de la Lista 1 de la Convención sobre Armas Químicas.[19] Así pues, la producción y el uso de estas sustancias están fuertemente restringidos.[20]
Véase también
[editar] Wikcionario tiene definiciones y otra información sobre mostazas nitrogenadas.
Wikcionario tiene definiciones y otra información sobre mostazas nitrogenadas.
Referencias
[editar]- ↑ «Mustards». The IUPAC Compendium of Chemical Terminology. 2014. doi:10.1351/goldbook.M04071.
- ↑ Daniel C. Keyes; Jonathan L. Burstein; Richard B. Schwartz; Raymond E. Swienton (2004). Medical Response to Terrorism: Preparedness and Clinical Practice. Lippincott Williams & Wilkins. p. 16. ISBN 978-0781749862.
- ↑ Centers for Disease Control and Prevention (4 de abril de 2013). «Facts About Nitrogen Mustards». cdc.gov. Archivado desde el original el 3 de septiembre de 2013. Consultado el 12 de septiembre de 2013.
- ↑ Chabner, Bruce A.; Roberts, Thomas G. (2005). «Chemotherapy and the war on cancer». Nature Reviews Cancer 5 (1): 65-72. PMID 15630416. doi:10.1038/nrc1529.
- ↑ Ghorani-Azam, Adel; Balali-Mood, Mahdi (1 de diciembre de 2015). «Clinical Pharmacology and Toxicology of Mustard Compounds». Basic and Clinical Toxicology of Mustard Compounds. Springer Science+Business Media. p. 64. ISBN 9783319238746. Consultado el 12 de marzo de 2019.
- ↑ Gilman A (May 1963). «The initial clinical trial of nitrogen mustard». Am. J. Surg. 105 (5): 574-8. PMID 13947966. doi:10.1016/0002-9610(63)90232-0.
- ↑ Jules Hirsch, MD; Journal of the American Medical Association (2006). «An Anniversary for Cancer Chemotherapy». JAMA (jamanetwork.com) 296 (12): 1518-1520. PMID 17003400. doi:10.1001/jama.296.12.1518.
- ↑ Hirsch J (September 2006). «An anniversary for cancer chemotherapy». JAMA 296 (12): 1518-20. PMID 17003400. doi:10.1001/jama.296.12.1518.
- ↑ Mattes, W. B.; Hartley, J. A.; Kohn, K. W. (1986). «DNA sequence selectivity of guanine–N7 alkylation by nitrogen mustards». Nucleic Acids Research 14 (7): 2971-2987. PMC 339715. PMID 3960738. doi:10.1093/nar/14.7.2971.
- ↑ Cheson BD, Rummel MJ (March 2009). «Bendamustine: rebirth of an old drug». J. Clin. Oncol. 27 (9): 1492-501. PMID 19224851. doi:10.1200/JCO.2008.18.7252.
- ↑ University of Durham. «SCHEDULE 1 CHEMICALS». dur.ac.uk.
- ↑ Geiduschek EP (July 1961). «"Reversible" DNA». Proc. Natl. Acad. Sci. U.S.A. 47 (7): 950-5. Bibcode:1961PNAS...47..950G. PMC 221307. PMID 13704192. doi:10.1073/pnas.47.7.950.
- ↑ Brookes P, Lawley PD (September 1961). «The reaction of mono- and di-functional alkylating agents with nucleic acids». Biochem. J. 80 (3): 496-503. PMC 1243259. PMID 16748923. doi:10.1042/bj0800496.
- ↑ Millard JT, Raucher S, Hopkins PB (1990). «Mechlorethamine Cross Links Deoxyguanosine Residues at 5'-GNC Sequences in Duplex DNA Fragments». Journal of the American Chemical Society 112 (6): 2459-60. doi:10.1021/ja00162a079.
- ↑ Rink SM, Solomon MS, Taylor MJ, Rajur SB, McLaughlin LW, Hopkins PB (1993). «Covalent structure of a nitrogen mustard-induced DNA interstrand cross-link: An N7-to-N7 linkage of deoxyguanosine residues at the duplex sequence 5'-d(GNC)». Journal of the American Chemical Society 115 (7): 2551-7. doi:10.1021/ja00060a001.
- ↑ Dong Q, Barsky D, Colvin ME, etal (December 1995). «A structural basis for a phosphoramide mustard-induced DNA interstrand cross-link at 5'-d(GAC)». Proc. Natl. Acad. Sci. U.S.A. 92 (26): 12170-4. Bibcode:1995PNAS...9212170D. PMC 40318. PMID 8618865. doi:10.1073/pnas.92.26.12170.
- ↑ Bauer GB, Povirk LF (March 1997). «Specificity and kinetics of interstrand and intrastrand bifunctional alkylation by nitrogen mustards at a G-G-C sequence». Nucleic Acids Res. 25 (6): 1211-8. PMC 146567. PMID 9092631. doi:10.1093/nar/25.6.1211.
- ↑ Guainazzi, A.; Schärer, O. D. (2010). «Using synthetic DNA interstrand crosslinks to elucidate repair pathways and identify new therapeutic targets for cancer chemotherapy». Cellular and Molecular Life Sciences 67 (21): 3683-3697. PMC 3732395. PMID 20730555. doi:10.1007/s00018-010-0492-6.
- ↑ Organisation for the Prohibition of Chemical Weapons. «Chemical Weapons Convention: Schedule 1 Toxic chemicals». opcw.org. Archivado desde el original el 7 de junio de 2013.
- ↑ United States Department of State, Bureau of Arms Control, Verification and Compliance; United States Department of Commerce, Bureau of Industry and Security (May 2004). «Introduction to Industry Implementation of the Chemical Weapons Convention». cwc.gov. Archivado desde el original el 20 de octubre de 2013. Consultado el 12 de septiembre de 2013.
Lectura adicional
[editar]- Stanford University School of Medicine (2013). «Topical Nitrogen Mustard (Mustargen)». stanford.edu.
- University of California, Los Angeles (2002). «Brassica alba or Sinapis nigra». ucla.edu.
