Interacción agóstica
Interacción agóstica es un término en química organometálica para la interacción de un metal de transición coordinadamente insaturado con un enlace C-H, cuando los dos electrones involucrados en el enlace C-H entran en el orbital d vacío del metal, resultando en un enlace de tres centros y dos electrones.[1] Se ha propuesto que muchas transformaciones catalíticas, por ejemplo la adición oxidativa y eliminación reductiva, proceden vía intermediarios que muestran interacciones agósticas. Las interacciones agósticas se observan en la química organometálica en ligantes alquilo, alquilideno y polienilo.
Historia
[editar]El término agóstico, derivado de la palabra griega para "mantener cerca a uno" fue acuñada por Maurice Brookhart y Malcolm Green para describir esta y otras interacciones entre un metal de transición y un enlace C-H. Frecuentemente, tales interacciones agósticas involucran a grupos alquilo o arilo que se mantienen cerca a centros metálicos a través de un enlace sigma adicional.[2][3]
Se han observado interacciones cortas entre sustituyentes hidrocarbonados y complejos metálicos coordinativamente insaturados desde la década de 1960. Por ejemplo, en el dicloruro de tris(trifenilfosfina)rutenio, se observa una corta interacción entre el centro de Ru(II) y un átomo de hidrógeno en la posición orto de uno de los nueve anillos fenilo.[4] Numerosos complejos de borohidruro también han sido descritos cristalográficamente, aunque también fueron descritos usando el modelo de enlace de tres centros y dos electrones.
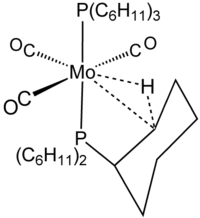
La naturaleza de la interacción fue delineada en la química de los grupos principales en la química estructural del trimetilaluminio.
Características de los enlaces agósticos
[editar]Las interacciones agósticas se demuestran mejor por cristalografía. La información de difracción de neutrones ha mostrado que las distancias de enlaces C-H y M-H son 5-20% más largas que las esperadas para los hidruros metálicos aislados e hidrocarburos.
- La distancia entre el metal y el hidrógeno es típicamente 1.8 - 2.3 Ǻ, y el ángulo de enlace cae en el rango 90 - 140°.
- La presencia de una señal 1H NMR que es desplazada campo arriba de un arilo o alcano normal, frecuentemente a la región normalmente asignada a los ligantes hidruro. Típìcamente, la constante de acoplamiento 1JCH es disminuida a 70-100 Hz, versus los 125 Hz esperados para un enlace carbono-hidrógeno sp3.
Fuerza del enlace
[editar]Por los estudios experimentales y de química computacional, la estabilización que surge de una interacción agóstica está estimada en 10-15 kcal/mol. En consecuencia, las interacciones agósticas son más fuertes que la mayoría de enlaces de hidrógeno. Algunas veces, los enlaces agósticos juegan un rol en la catálisis al incrementar la 'rigidez' en el estado de transición. Por ejemplo, en la catálisis de Ziegler-Natta, el centro metálico altamente electrofílico tiene interacciones agósticas con la cadena de polímero creciente. Esta rigidez incrementada influencia la estereoselectividad del proceso de polimerización.
Referencias
[editar]- ↑ "Agostic Interaction". IUPAC Compendium of Chemical Terminology. 21 Jan 2008. http://www.iupac.org/goldbook/AT06984.pdf Archivado el 10 de junio de 2007 en Wayback Machine.
- ↑ Maurice Brookhart, Malcolm L. H. Green, Carbon-hydrogen-transition metal bonds. Journal of Organometallic Chemistry, 250(1), 395-408 (1983). doi 10.1016/0022-328X(83)85065-7.
- ↑ Maurice Brookhart, Malcolm L. H. Green, and Gerard Parkin "Agostic interactions in transition metal compounds" Proceeding of the U.S. National Academy of Sciences 2007, volume 104, 6908–6914.doi 10.1073/pnas.0610747104
- ↑ Sam J. La Placa and James A. Ibers "A Five-Coordinated d6 Complex: Structure of Dichlorotris(triphenylphosphine)ruthenium (II)" Inorganic Chemistry, 1965, volume 4, pp 778 - 783. doi 10.1021/ic50028a002
Enlaces externos
[editar]- Unión Internacional de Química Pura y Aplicada. «agostic». Compendium of Chemical Terminology. Versión en línea (en inglés).
